Inscription / Connexion Nouveau Sujet
Exercice Oxydoréduction/Dosage 1re S
Bonjour, pouvez vous m'aidé pour cette exercice svp car je ne comprend vraiment pas :
1°/ Une solution de diiode I2 est dosée avec une solution de thiosulfate de sodium (2Na+ + S2O3 2-) de concentration en ion thiosulfate S2O3 2- C1= 0,10 mol.L-1 en présence d'empois d'amidon .
L'équation de la réaction de dosage est : 2S2O3 2- (aq) + I2 (aq) ------> 2 I-(aq) + S4O6 2- (aq) .
1.1. Donner les demi équations d'oxydoréduction des couples intervenant dans cette réaction de dosage .
1.2 Expliquer comment l'équivalence est expérimentalement reprérée lors de ce dosage .
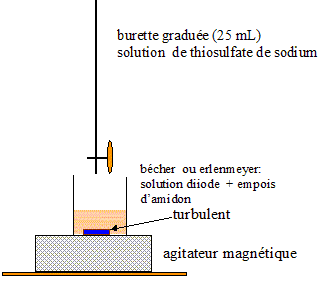
1.3 Indiquer la nature et l'emplacement de la solution titrée et de la solution tirante dans le montage expérimental .
1.4 La concentration C1 est elle égale à celle des ions sodium ? Justifier .
1.5 Donner la définition de l'équivalence .
1.6 L'équivalence est atteinte quand le volume de solution de thiosulfate de sodium est égal à Véq = 4,2 mL . Déterminer, à l'aide d'un tableau d'avancement, la quantité de matière de diiode dosée .
2°/ La quantité de diiode dosée précédemment à été formé en faisant réagir un volume V2 = 10,0 mL d'une solution diluée de dichromate de potassium (2K+ + Cr2O7 2- ) de concentration en ion dichromate
Cr2O7 2- (aq) + 6I- (aq) + 14H+ (aq) ----> 3I2 (aq) + 2Cr3+(aq) + 7 H2O (l) .
Déterminer la concentration en ions dichromate C2 .
Bonjour,
1.1- I2 + 2e- -> 2I-
2S2O32- -> S4O62- + 2e-
1.2- L'équivalence est observée par un changement brutal de couleur de la solution :
elle devient incolore. En effet le diiode a une couleur marron et l'ion iodure formé est incolore.
1.3- solution titrée : le diiode dans le bécher
solution titrante : le thiosulfate de sodium
1.4- La solution de thiosulfate de sodium est (2Na+ + S2O32-). En regardant les coefficients des deux ions, on remarque que pour une mole
de Na2S2O3 dissoute dans l'eau, il se forme une mole de S2O32- et deux moles de Na+.
Donc [Na+]= 2C1.
1.5- L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques.
1.6- L'équation de la réaction du dosage est 2S2O32- (aq) +1I2 (aq) ------> 2I-(aq) + S4O62- (aq) .
Schéma annoté du dosage à faire :
dans la burette : (2Na+ + S2O32-)
- de concentration C1 =0,10mol/L
- de volume VE = 4,2x10-3 L = volume versé à l'équivalence.
dans le bécher : le diiode
- de volume V2 = IL MANQUE LA VALEUR DANS TON ENONCE !!!
- de concentration C2 = inconnue.
A l'équivalence,
n(I2 dans Va)/1 = n(S2O32- dans VE)/2 (les coefficients sont ceux devant les réactifs dans l'éqation du dosage)
<=> C2*V2 = C1*VE
<=> C2 = ......
Tu peux en déduire la quantité de matière de diiode