Inscription / Connexion Nouveau Sujet
combustion
Bonjour s il vous plait est ce que ce serait possible de me donner un coup de main pour cet exercice (j'ai deja commence a repondre aux premieres questions) en chimie merci d'avance 
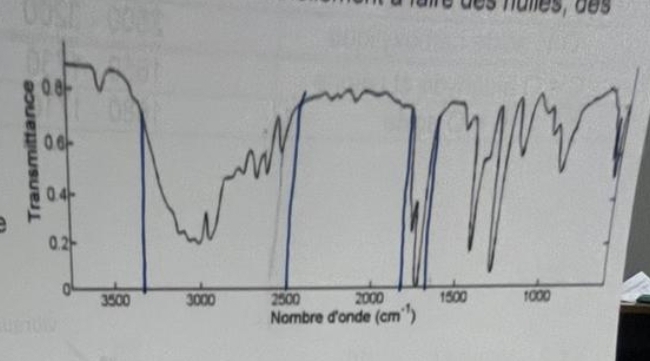
d'apres le spetre de spectroscopie (piece jointe) donnez la formule semi-développée et Formule brute de l'acide stéarique. Entourer et nommer son groupe caractéristique. En analysant le spectre infrarouge de l'acide stéarique dilué (ci-contre), montrer qu'on peut confirmer qu'il s'agit bien d'un acide carboxylique.
Partie B
On considère la combustion dans 30 L de dioxygène d'une bougie constituée de 100 g d'acide stéarique. Il se forme du dioxyde de carbone et de l'eau.
a) Une combustion est-elle une transformation physique, chimique ou nucléaire ? Est-elle exothermique ou endothermique ?
b) Dresser le tableau d'avancement de cette combustion avec les valeurs numériques de toutes les quantités de matière à l'état initial et à l'état final en supposant la réaction totale et le rendement égal à 100%. Détailler chaque calcul précisément.
c) La combustion de toute la bougie permet de chauffer dix litres d'eau. L'eau chauffée passe alors de 0,= 23°C à 0,= 80°C. On considère que toute l'énergie thermique libérée par la combustion a permis de chauffer l'eau et qu'aucune énergie n'a été dissipée dans l'atmosphère. Calculer l'énergie E libérée lors de cette combustion: En déduire l'énergie molaire de la combustion de l'acide stéarique E, et son pouvoir calorifique massique PC,.
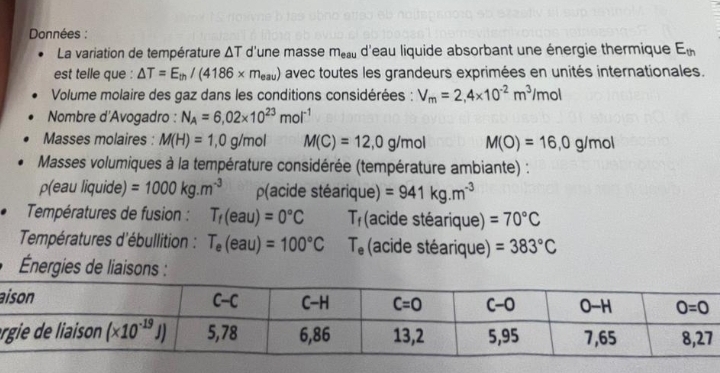
d) Grâce aux énergies de liaison données, calculer la valeur théorique de E, et en déduire la proportion d'énergie dissipée dans l'atmosphère au cours de la combustion considérée dans la
question précédente.
e) Montrer que l'énergie molaire de la combustion du butane dans le dioxygène est E,= 2,53 MJ.mol¹.
f) Pour produire 1 J d'énergie thermique, parmi les deux combustibles étudiés, quel est celui qui émet le moins de CO₂ et est donc le plus écologique ? Justifier précisément.
Bonjour
Et si tu commençais par exposer ce que tu as réussi à faire et à poser des questions précises sur ce qui te bloque ? Plus facile de t'aider ensuite en tenant compte de ton niveau !
Bonjour
Tout d'abord pour la première question j'ai dis que on peut voir la resence d'une bande d'absoprion vers a peu pres 1700 cm caracterisique de liaison C=O puis une band emoyenne et large vers 3000 cm caracteristique de liaosn O-Hd'un alcool lié donc la molecule porte le groupe caracteristique carboxyle- COOH on peut confirmer qu'il s'agit d' un acide carboxylique.
Mais je sais pas comment avoir la formule semi-développée et Formule brute de l'acide stéarique ?? Je pense qu'il manque des données a l'enoncé
Partie B
a) Une combustion est une transformation chimiqueau cours de laquelle des reactifs disapraissrnt et des produits apparaissent et elle est exothermique car elle libere toujours de l'energie sous forme de chaleur
b) on a l'equation C18H36O2 + 26 O2 → 18 CO2 + 18 H2O
ni(acide stéarique) = m(acide stéarique) / M(acide stéarique)
n(acide stéarique) = 100 g / 284 g/mol
n(acide stéarique) = 0,352 mol
ni(dioxygène) = V(dioxygène) / Vm(dioxygène)
n(dioxygène) = 30 L / 24l/mol
n(dioxygène) = 1,25 mol
Ensuite j'ai fais un tableau d'avancement et j'ai cherche le reactif limitant j'ai trouve que reactf limitant est O2 et donc xf= 4,8*10-2 mol
Ainsi : n(acide stearique) final = n(acide) - xf
n(acide steraique) final = 0,352 mol - 4,8*10-2 mol
n(acide stearique) final =0,304 mol
n(dioxygène) final = n(dioxygène) - 26 xf
n(dioxygène) final = 1,25 mol - 26*4,8*10-2 mol
n(dioxygène) final = 2*10-3 mol
n(CO2) final = 18 *4,8*10-2 =0,864 mol
n(H20) final = 18 *4,8*10-2 =0,864 mol
D'accord avec ce que tu as fait : le spectre infrarouge permet bien de montrer qu'il s'agit d'un acide carboxylique mais il ne permet pas d'obtenir la formule moléculaire. Il faudrait en plus un renseignement sur la masse molaire : oubli dans ta copie ou oubli du concepteur de l'énoncé ?
Ton tableau d'avancement est correct mais attention à la gestion des arrondis de calculs. A la question b) la quantité de dioxygène reste doit être nulle puisqu'il s'agit du réactif limitant.
d'accord
c) ensuite j'ai utilise la formule E(th)= t*4186*m (eau) = 57° *4186*(1*10) = 2 386 020 J
t*4186*m (eau) = 57° *4186*(1*10) = 2 386 020 J
Es = E(th) * 6,02 * 1023 = 1,43*1030 J/mol
PC= -E(th)/ m (combustible)= -2 386 020 *100 =-2 386 02000 J/g
On te demande l'énergie molaire et l'énergie massique. Je ne vois pas ce que vient faire la constante d'Avogadro pour l'instant.
Tes valeurs numériques sont très difficiles à déchiffrer. Il faut utiliser les puissances de dix et arrondir en fonction de la précision des données.
E(th)=t*4186*m (eau) = 57° *4186*(1*10) = 2, 3*10 6J
du coup je ne comprends pas quelle formule utiliser ? Emolaire=E(th)/-n(combustible)= 2, 3*10 6 */ 0,304 mol = 7,2*105 J/mol
Pour le pouvoir calorifique je connais la formule PC= -E(th)/ m (combustible) mais est ce qu'il faut utiliser l amasse du combiustioble a la fin ou debut de reaction ?
ah non je me suis trempé : Emolaire=-E(th)/n(combustible)= -2, 3*10 6 / 0,352 mol = -6,5*106 J/mol
et du coup PC= -E(th)/ m = -2, 3*106 / 100 g =-2, 3*104
Oubli des unités pour le pouvoir calorifique massique. Sinon : les ordres de grandeurs sont bons mais les calculs et leurs arrondis sont menés de façon maladroite. Il convient ici d'arrondir les résultats demandés avec trois chiffres significatifs mais il faut conserver dans la calculatrices tous les chiffres significatifs. Sinon, les arrondis successifs peuvent finir par rendre les résultats inacceptables.


