Inscription / Connexion Nouveau Sujet
chimie organique
Bonsoir, pourriez vous m'aider à comprendre cet exercice?
Le voilà:
Le craquage du décane se fait à 700°C et donne, selon deux réactions possibles, les composés A,B, C, D, E et du dihydrogène. Le mélange est ensuite refroidi à température ambiante (20°C).
A est le benzène, de formule brute C6H6. B, C et D sont des gaz à température ambiante. D et E donnent des polymères par polyaddition. E est linéaire et ne présente aucun isomère Z ou E. D donne, avec A, le 2-phénylpropane, aussi appelé cumène, de formule brute C9H12. B et C ne décolorent pas l'eau de dibrome (donc sont des alcanes) et ne présentent pas de ramifications. B est gazeux à -20°C. Les formules brutes du décane et des composés A, B, C D et E sont données, ainsi que leurs températures d'ébullition en °C
*C2H6 -> -88,6
*C3H6 -> -47,6
*C4H10 -> -0,5
*C5H10 -> 30
*C6H6 -> 80,1
*C10H22 -> 174
La constante des gaz parfaits est R=8,314 J.K-1.mol-1. Tous les gaz seront considérés comme parfaits.
1)Identifier les composés B, C, D et E : donner leurs noms, leurs formules brutes et topologiques. Détailler le raisonnement.
2)Ecrire les équations des deux réactions concurrentes qui se produisent lors du craquage du décane.
3)Le craquage se fait dans une enceinte de volume V=1000L en présence d'un catalyseur solide. A pression ambiante P0=1,013 bar, on remplit l'enceinte de décane à 700°C. Les deux réactions se produisent alors au contact du catalyseur. On maintient la température suffisamment longtemps pour que tout le décane soit consommé. On constate qu'alors la pression dans l'enceinte a été multipliée exactement par 3,50. Déterminer les quantités de matières de chacun des produits obtenus, ainsi que les volumes qu'ils occupent à la température de 20°C et à pression atmosphérique si ce sont des gaz à cette température, leurs masses sinon.
4)Déterminer la masse de cumène que l'on peut obtenir au maximum avec les produits du craquage.
___________________________________________________________
1)J'ai du mal à voir de quels hydrocarbures il s'agit en étudiant les différentes informations. Pourriez vous me mettre sur la voie?
2), 3) et 4), à voir après
Merci d'avance.
B,C,D gaz à la température ambiante (20°C)
B,C,D bouillent donc à une température < 20°C
B,C,D sont à choisir parmi C2H6,C3H6,C4H10
D et E sont des alcènes(se polymérisent) :C3H6 ou C5H10
D est un alcène gazeux à 20°C :C'est C3H6
donc E est C5H10
B et C sont soit C2H6 soit C4H10
Or B est gazeux à -20°C.Sa température d'ébullition est donc inférieure à
-20°C .B est donc C2H6
C est donc C4H10
J'arrête pour ce soir .Bonsoir
J'ai bien compris comment tu avais résolu la question 1).
Il faut trouver les formules topologiques. J'ai trouvé celle de C4H10 déjà.
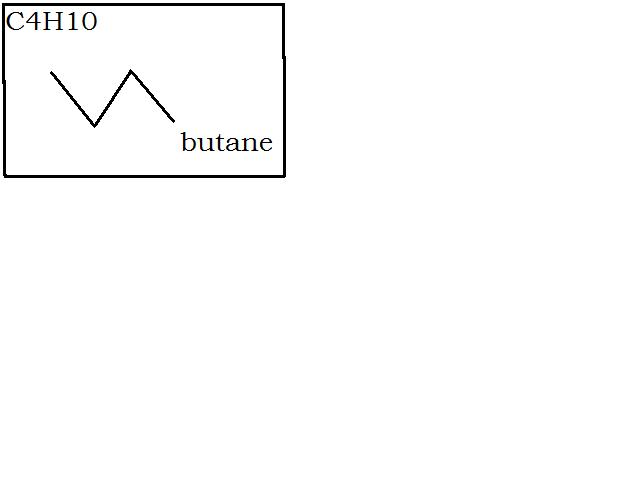
bonjour,
oui ,c'est bon
Peux tu m'indiquer les produits de craquage du décane pour chacune des 2 réactions?
1)Peux tu me donner une technique qui permet de trouver facilement les formules topologiques de A, B , D et E?
2)Quelles deux réactions?
Voilà j'ai complété pour la question 1) 
2) Tu parles de réactions entre le décane et une molécule inconnue?
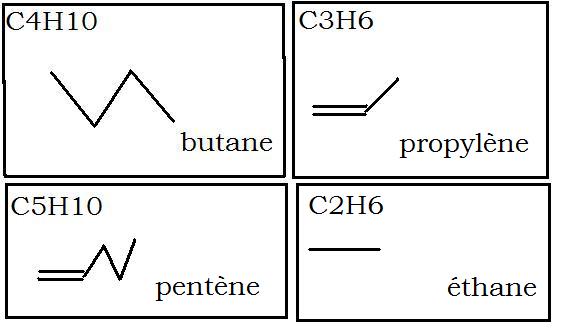
A:cycle benzénique (hexagone avec une double liaison sur 2 =formule de Kékulé)
il faut commencer par la formule semi développée
B C2H6 :CH3 -CH3 = un trait horizontal
C C3H6 : CH2== CH --CH3
ensuite on supprime les C et H
D il n' y a pas d'isomères Z et E si 2 groupes liés à un des carbones de la double liaison sont identiques.
C5H10
CH2== CH --CH2-- CH2--CH3
on aura donc un zig zag formé de 4 morceaux,le premier étant double
2)Quelles deux réactions?
celles de la question 2
1)Normalement c'est ok.
2)En fait, les réactions se produisent entre les produits du craquage du décane, c'est à dire les composés A,B,C,D,E?
c'est bon pour les formules
c'est plutôt propène que propylène (ancienne nomenclature)
2)il faut écrire 2 équations de réaction.
j'avoue que je coince car les produits de chacune ne sont pas précisés et ,
je trouve quelque chose qui ne colle pas avec la suite du pb....
Moi je dirais que le craquage du décane peut :
- soit du proprène, du pent-1-ène et de l'éthane (première réaction) ;
- soit du butane, du benzène et du dihydrogène (deuxième réaction).
Dans les deux cas, on a bien dix atomes de carbone et vingt-deux atomes d'hydrogène (en choisissant un coefficient stchiométrique adapté pour le dihydrogène dans la seconde réaction).
Je ne comprends pas bien comment marche ce craquage, le décane ne réagit pas?
De plus, comment as tu trouvé ces deux solutions?
Merci beaucoup de venir sur cet exercice 
Je te renvoie à ton cours : regarde en particulier la définition du craquage.
Il s'agit de casser des chaînes carbonées pour en obtenir des plus courtes : on obtient des alcanes et des alcènes.
On distingue le vapocraquage (très hautes températures + vapeur d'eau) et le craquage catalytique (températures un peu moins élevées + catalyseurs).
Comment j'ai trouvé ces réactions ? C'est simple : tu dois avoir dix carbones à gauche (craquage d'un décane) et dix carbones à droite. Or l'énoncé te parle de composés qui ont soit deux, soit trois, soit quatre, soit cinq, soit six carbones. Comment obtenir dix ? 6+4 ou 2+3+5, non ? (je ne vois pas d'autre solution...) Ensuite, il faut équilibrer les atomes d'hydrogène : c'est bon pour la première réaction, pour la seconde il en manque d'où le dihydrogène comme produit (cf: énoncé) avec un coefficient stchiométrique habilement choisi.
Mais, pour la première réaction par exemple , le décane est le seul réactif et les produits sont le proprène, le pent-1-ène et l'éthane, c'est cela?

merci masterr d'avoir pris le relais.
J'avais bien trouvé ces équations ,mais je trouve que le nombre de mol est multiplié par 4 et non 3,5.(2 mol de C10H22 produisent 8 mol de corps gazeux ,à 700°C).C'est ce qui m'a arrêté dans mes explications.
Qu'en penses tu?
Mais, pour la première réaction par exemple , le décane est le seul réactif et les produits sont le proprène, le pent-1-ène et l'éthane, c'est cela?
Oui, c'est bien ce que j'ai dit dans mon premier message

De rien coriolan 
Tu as fait une petite erreur de raisonnement : la loi des gaz parfaits de s'appliquant qu'aux espèces gazeuses. Or le composé E n'est pas à l'état gazeux. On a donc 2 mol de décane qui donnent 7 mol de composés à l'état gazeux : le produit est donc bien multiplie par 3,5.
C'est équilibré, oui, mais je ne vois pas pourquoi tu viens d'écrire la réaction dans l'autre sens cette fois ? Elle se fait bien dans le sens que tu avais indiqué précédemment...
Heu oui j'ai recopié un brouillon où je n'avais pas encore bien compris.
A lire dans l'autre sens donc.
Il faut savoir prendre des initiatives de temps en temps !
Qu'est-ce que c'est que cette formule ? (horreur...) Si tu souhaites appliquer la loi des gaz parfaits, il s'agit de où P est la pression (en pascals), V le volume (en mètres cubes), n la quantité de matière (en mol), R la constante des gaz parfaits et T la température (en kelvins).
P mal écrit donc pris pour un rho..
on a donc P0*3,50*V=nR*293,15 et n vaut pour les composés B, C et D
Tu calcules la quantité de matière initiale du décane puis à l'aide d'un tableau d'avancement tu en déduis les quantités de matière des produits, selon la stchiométrie des réactions, dans les conditions de température et de pression demandées.
pour masterr
23/3 19h40
Or le composé E n'est pas à l'état gazeux. .....
pourquoi E n'est-il pas gazeux à 700°C ?
y a quelque chose qui m'échappe!
Ah oui, effectivement.
Ensuite le mélange est refroidi mais, vu comme la question est posée, la pression est multipliée par 3,5 à 700°C où, en effet, tous les composés devraient être à l'état gazeux...
Et puis même, à 20°C on aurait également le benzène qui serait à l'état gazeux dont d'où sort le 3,5 ?
plus exactement ,à 20°C le benzéne et C5H10 seraient liquides,et il n'y aurait plus que 6 moles gazeuses pour 2 mol de décane craquées ,soit une augmentation de pression d'un facteur 3.
Etant maintenant 2 à se poser des questions sur l'énoncé,on peut douter de son exactitude.
pour que Romane puisse comprendre pourquoi on se posent des questions sur l'énoncé ,voici quelques détails
l'énoncé nous dit que 2 réactions se produisent lors du craquage du décane.
les produits du craquage étant A,B,C,D,E et H2
2 équations satisfont le principe de conservation du nb d'atomes
pour chaque équation il y a bien 10C et 22 H de chaque côté.
si on fait la somme des deux équations on obtient
à l'état initial
P1*V1=n1*R*T1
àl'état final
P2*V2=n2*R*T2
or V et T sont constants
on peut écrire P1*V=n1*R*T et P2*V=n2*R*T
soit en divisant membre à membre
P2/P1=n2/n1
A 700°C (on dit que l'on maintient la température constante),tous les produits sont à l'état gazeux.
2mol à l'état gazeux de C10H22 produisent 8 mol de corps à l'état gazeux.
le rapport du nombre de mol de gaz final (n2) et initial (n1) vaut 8/2=4
donc P2/P1=4
Or dans l'énoncé on écrit que P2/P1=3,5
Je pense donc qu'il y a une erreur.
Si je me trompe,je ne vois pas où.
Merci de m'expliquer tout ça 
Tu dis que V et T sont constants, si j'ai bien compris tu parles de V=1000L et T=700°C ?
Je n'ai jamais vraiment compris à quoi ça servait de diviser membre à membre deux égalités pouvez vous m'expliquer?
Comment sais tu qu'à la température T tous les composés sont gazeux?
D'où vient tout ça ? :
2mol à l'état gazeux de C10H22 produisent 8 mol de corps à l'état gazeux.
le rapport du nombre de mol de gaz final (n2) et initial (n1) vaut 8/2=4
De plus, pourquoi ces calculs mènent ils à connaitre les quantités de matières de chacun des produits obtenus ainsi que les volumes qu'ils occupent à la température de 20°C et à pression atmosphérique si ce sont des gaz à cette température, leurs masses sinon?
Merci encore à vous deux

Je serais d'avis pour que tu demandes à ton professeur s'il n'y a pas d'erreur sur le facteur multiplicatif 3,5 : nous serons ainsi fixés.
Tu dis que V et T sont constants, si j'ai bien compris tu parles de V=1000L et T=700°C ?
Oui.
Je n'ai jamais vraiment compris à quoi ça servait de diviser membre à membre deux égalités pouvez vous m'expliquer?
On te dit que la pression est multipliée par 3.5, il apparaît donc naturel de se demander ce que vaut le rapport P2/P1 en utilisant deux fois la loi des gaz parfaits.
Comment sais tu qu'à la température T tous les composés sont gazeux?
Les températures d'ébullition sont données dans l'énoncé !
D'où vient tout ça ? :
Citation :
2mol à l'état gazeux de C10H22 produisent 8 mol de corps à l'état gazeux.
le rapport du nombre de mol de gaz final (n2) et initial (n1) vaut 8/2=4
1 mol de décane donne les produits de la première réaction, 1 autre mol de décane donne les produits de la seconde réaction donc 2 mol de décane donnent tous les produits. Pour 2 mol de décane on obtient donc 1 mol de chaque produit sauf pour le dihydrogène où on obtient 3 mol à cause du coefficient stœchiométrique : si tu comptes correctement (coriolan a reproduit les équations des transformations dans son message), tu obtiendra 8 mol de produits à l'état gazeux.
De plus, pourquoi ces calculs mènent ils à connaitre les quantités de matières de chacun des produits obtenus ainsi que les volumes qu'ils occupent à la température de 20°C et à pression atmosphérique si ce sont des gaz à cette température, leurs masses sinon?
Avec les quantités de matière des produits, en utilisant la loi des gaz parfaits, tu peux calculer le volume ou la masse correspondante.
* T_P : balises corrigées *
masterrr je pense que tu peux accéder à la réponse de mon prof: il est "à peu près sûr" de la donnée 3,50.
Dis-lui que selon toi, 2 mol de décane donne 1 mole de A, 1 mole de B, 1 mole de C, 1 mole D, 1 mole de E et 3 mol de dihydrogène d'où 8 mole de composés à l'état gazeux. La pression devrait donc être augmentée d'un facteur 8/2=4.
Dis-nous ce qu'il te répond.
D'accord, tu peux donc te demander combien de fois se produit la deuxième réaction lorsque la première se produit une fois sachant que la pression doit être multipliée par 3,5.
En notant la pression initiale et
la pression finale, la loi des gaz parfaits fournit :
où
est la quantité de matière de gaz finale et
la quantité de matière de gaz initiale.
Or l'énoncé dit que d'où
soit
.
Si tu notes l'avancement de la première réaction et
l'avancement de la seconde, tu as donc (après avoir fait un beau tableau d'avancement
 ) la relation :
) la relation : .
De plus, on doit avoir (l'avancement total ne peut pas être supérieur à la quantité initiale de réactif).
Tu as donc un système de deux équations à deux inconnues et
. En le résolvant, tu auras
et
. Tu pourras compléter ton tableau d'avancement en calculant les valeurs numériques des différentes quantités de matière.
Pour les espèces gazeuses, tu pourras calculer leur volume grâce à la loi des gaz parfaits et pour les espèces solides, tu pourras calculer leur masse en utilisant la formule .
Je te laisse méditer là-dessus 
eh oui ,je suis passé à côté de ce détail!Je me suis fait avoir
si on fait réagir n mol de C10H22:
n1 mol de C10H22 produisent 3 n1 mol de gaz
n2 mol de C10H22 produisent 5n2 mol de gaz
d'autre part n=n1+n2
à l'état initial on a n1+n2 mol de gaz
à l'état final on a 3n1 +5n2 mol de gaz
P2/P1= (3n1+5n2)/(n1+n2)=3,5
3n1 +5n2=3,5 n1 +3,5n2
0,5n1=1,5n2
n1=3n2
on peut calculer n avec les données (V=1000 L ,P=1,013 bar,T=700°C).
Attention aux unités
Utilise PV=nRT
une fois n calculé,on peut trouver n1 et n2
on aura donc n1 mol de C2H6 ,n1 mol de C3H6 ,n1 mol de C5H10,n2 mol de benzène ,n2 mol de butane et 3 n2 mol de H2
bonsoir
Coriolan a fait pareil que moi, enfin presque...
J'ai voulu aller trop vite et je me suis emmêlé les pinceaux.
Il faut donc corriger une équation de mon message précédent : il ne s'agit pas de mais de
.
 Ce n'est pas faux : surtout quand on essaye de répondre aux questions quasiment de tête, ce qui conduit à quelques erreurs (cf: mon message précédent...).
Ce n'est pas faux : surtout quand on essaye de répondre aux questions quasiment de tête, ce qui conduit à quelques erreurs (cf: mon message précédent...).
Maintenant, au boulot Romane !
Le fait que les réactifs ne sont pas équiprobables nous a échappé ; c'est tellement rare d'étudier des réactions simultanées en première (et même en terminale). Je ne m'en rappelle pas en avoir traité avant la prépa.

 C4H10+C6H6+2H2
C4H10+C6H6+2H2

 V= nRT
V= nRT


