Inscription / Connexion Nouveau Sujet
Je n'ai pas pu me connecter plus tôt. Je reviens demain pour voir tout ça. J'avoue que je suis un peu perdue, ça fait rien si on reprend plutôt dès le début? Car je ne saisi pas tout de ce que vous avez écrit.
Merci 
les molécules ABCDE ont été identifiees.
il n'est pas utile de recommencer la 1ère question
question 2
On nous dit que 2 réactions se produisent lors du craquage du décane.
les produits du craquage étant A,B,C,D,E et H2
réaction 1 (R1)
réaction 2 (R2)
Ces 2 équations satisfont le principe de conservation du nb d'atomes
question 3
si on introduit n(i) mol de C10H22 dans le réacteur,n1 mol réagissent selon R1 et n2 mol selon R2
n(i)=n1 +n2
tu fais 2 tableaux d'avancement
un pour R1 et un pour R2
cela permet de trouver le nb de mol de produits obtenus en fonction de n1 et n2.
la suite à été expliquée
n1 et n2 ne sont pas connus .
Ce que l'on sait ,c'est que n1+ n2 = n(i)
n(i) peut ëtre calculée en utilisant P*V=n(i)*R*T (V=1000L, P=1,013 bar)
mais,dans un premier temps ,tu n'as pas besoin de calculer n(i)
Tu fais un tableau pour la réaction R1 (la qté initiale de C10H22 sera n1 et la qté finale 0) et un tableau pour la réaction R2 (la qté initiale de C10H22 sera n2 et la qté finale 0)
ni c'est quantité de matière initiale de C10H22?
De plus, comment savoir quelle est la réaction qui se produit plus que l'autre, puisqu'on est pas sûrs qu'elles se produisent autant l'une que l'autre?
D'après le tableau on obtient 3 mol de n1 et 5 mol de n2, peut on dire ça? 
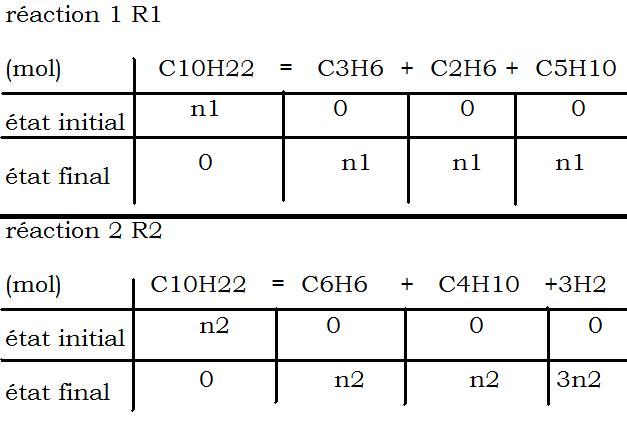
les tableaux sont bons.
Rien ,dans l'énoncé ,n'indique que les 2 réactions se font dans les mêmes proportions .(C'est l'erreur que j'ai faite au début)
d'après le tableau
R1 produit 3*n1 de corps gazeux
R2 produit 5*n2 de corps gazeux
la réaction de n(i) mol de C10H22 produit 3n1 +5n2 mol de corps gazeux
à létat initial
Pi*Vi=ni.R.Ti
à l'état final
Pf*Vf=nf.R.Ti
or Vi=Vf=V=1000L et Ti=Tf=T=700°C
on a donc
Pi*V=ni.R.T et
Pf*V=nf.R.T
en divisant membre à membre,et en simplifiant par V,R,T on obtient
Pi/Pf=ni/nf ou Pf/Pi=nf/ni
or,d'après l'énoncé Pf/Pi=3,5
donc nf/ni=3,5 soit (3.n1 +5n2)/(n1+n2)=3,5
cette équation permet de trouver une relation entre n1 et n2 (eq1)
d'autre part on a posé n(i)=n1+n2 (eq2)
avec les données on peut calculer n(i) en utilisant la loi des gaz parfaits.
en combinant eq1 et eq 2(avec la valeur de ni) on trouve la valeur de n1 et n2 .
Cela permet de connaître les qtés de matière des produits.
A 25°C ,il faut identifier les produits gazeux et non gazeux.
pour les produits gazeux on calcule leur volume en utilisant la loi des gaz parfaits
pour les produits non gazeux on calcule leur masse en utilisant m=n/M
Restera la question du cumène
En fait quand tu écris "la réaction de n(i) mol de C10H22 produit 3n1 +5n2 mol de corps gazeux", tu parles de l'équation de réaction qu'on obtient quand on fait la somme membre à membre de R1 et R2, le réactif est donc 2C10H22?
quand tu dis "à létat initial Pi*Vi=ni.R.Ti", c'est cette réaction aussi?
2C10H22=..
ni c'est la quantité de matière de quoi exactement? 
Pourquoi 25°C?
Merci beaucoup
n(i) est la qté de matière que l'on introduit dans le réacteur
tu peux calculer n(i) avec les données (V=1000L et P=1,013bar;attention aux conversions pour utiliser PV=nRT)
une partie de cette qté de matière (n1) réagi selon R1 et l'autre (n2) selon R2
Si tu suis le détail de mon post précédent,tu peux calculer n1 et n2
Pourquoi 25°C?
relis la troisième question
Dans la troisième question je ne vois pas de 25°C.. 
Que penses tu de mes deux premières questions de 15:11? 
C'est 20°c et non 25°C ....(mauvaise mémoire)
Il ne faut pas utiliser 2 C10H22 :il ne faut pas confondre les coefficients stoechiométriques avec les quantités de matières en jeu
il faut considérer les réactions R1 et R2 séparément puis finalement additionner les qtés initiales et finales .Soit;
n(i)=n1 +n2 et n(f)=3.n1 +5n2
On te demande les équations de réaction concurentes
c'est fait
quelle valeur pour n(i) ?
n(i) peut ëtre calculée en utilisant P*V=n(i)*R*T (V=1000L, P=1,013 bar)
quelle valeur pour n1 et n2 ?
il faut résoudre le système
ni=n1+n2 (utiliser la valeur de ni calculée)
(3.n1 +5n2)/(n1+n2)=3,5
une fois n1 et n2 calculé on connait la qté de matière de chaque produi obtenu
1 bar = 100 000 pascals
donc ni= 1101300*1/(8,314*973,15)=136,1 mol
je trouve n1=102,1 mol
donc n2=ni-n1=34,0 mol
cette fois ça devrait être la bonne 
mais comment convertir des bar en pascals?
pour ce type de question,google est utile ,ou un livre!
1bar=100 000Pa
si je lis bien,P=1,013 bar soit 101300Pa
tu as fait une erreur de copie pour P
n(i)=12,5 mol
n(i)=n1 +n2 donc
n1 +n2 =12,5 (eq 1)
d'autre part
n(f)/n(i)= 3,5
(3n1 +5n2)/(n1 + n2)=3,5 (eq2)
à partir de eq 1et eq 2 trouve n1 et n2
en développant et en réorganisant l'eq 2,on trouve n1=3n2
en reportant dans l'eq 1,on trouve
n1=9,4 mol et n2 3,1 mol
On a ainsi les valeurs des qtés de matière des corps obtenus a 700°C (n(H2)=3*n2)
on demande les volumes des corps gazeux à 25°C sous 1,013 bar.
Il faut sélectionner les corps gazeux à 25°C (voir énoncé) et appliquer PV=nRT
n vaudra ,selon le cas, n1 ,n2 ou 3n2 pour n(H2)
pour les produits non gazeux à 25°C,il faut calculer la masse avec m=n*M
J'ai aussi trouvé ces valeurs pour ni, n1 et n2 mais que penses tu des chiffres significatifs?
J'ai ni=12n52mol
n1=9,39mol
n2=3,13mol
Quand tu dis 25°C, en fait, c'est 20°C non?
à 20°C, on a C2H6,C3H6,C2H10,H2 qui sont gazeux (utilisation de PV=nRT)
à 20°C, C5H10 et C6H6 ne le sont pas (utilisation de m=nM)
à20°C et à pression, les gaz C2H6 et C3H6 occupent un volume
V1=9,39*8,314*293,15/(1,013*100000)=0,226 L
C4H10 occupe un volume V2=3,13*8,314*293,15/(1,013*100000)=0,0753L
H2 occupe un volume V3 = 9,39*8,314*293,15/(1,013*100000)=0,223L
la masse de C5H10 obtenue est m1=9,39*70=657,3g
masse de C6H6 m2=3,13*78=244,1g
Trouves tu pareil?
Quel est ton avis sur les chiffres significatifs?
Avant de passer à la 4) 
oui,c'est 20°C et non 25°C!
Attention !Les volumes trouvés sont en m3 et non en L
OK pour les masses
3 chiffres significatifs suffisent
Ha oui!
V1=0,226m3
V2=0,0753m3
V3=0,223m3
m1=657g
m2=244g
On part sur ces bases?
4)On a m2 la masse de cumène obtenue, mais as tu compris ce que veut dire "au maximum"?

A, le 2-phénylpropane, aussi appelé cumène, de formule brute C9H12
pour mieux s'y retrouver , quels sont les éléments que tu disposes pour celui-ci ?
"D donne, avec A, le 2-phénylpropane, aussi appelé cumène, de formule brute C9H12", ça veut dire qu'après avoir été produits, le C3H6 et le C6H6 réagissent ensemble pour donner du cumène?
Je trouve 376g car on a une quantité de matière de cumène qui vaut n2. Que trouves tu?
donc logiquement ce doit être la réponse , mais vu que je n'ai pas suivi le topic depuis le début ....
En utilisant moins de chiffres significatifs je trouve une masse de 373g pour la 4), pensez vous que c'est trop éloigné de 376 g trouvé avant?




