Inscription / Connexion Nouveau Sujet
TP Solubilité
Bonjour, j'ai un TP à préparer et je voudrais essayer de vraiment préparer le TP avant les manipulations, voici le début du TP pour le référencement :
« Durant ce TP une succession d'expériences indépendantes les unes des autres
seront menées. Ces expériences portent sur la solubilité et sur les différents
facteurs pouvant influer sur ce phénomène. […] »

PDF - 312 Ko
J'ai fait pour l'instant les deux premières questions (sans manipulations, avec des recherches sur internet) :
Apres avoir ajouté 10g de sel, le temps de dissolution est de…
Apres 20g,…
Après 30g,…
Après avoir ajouté 40g on observe que le sel ne se dissous pas et que des cristaux restent au fond malgré l'agitation vive.
Cela s'explique car l'eau salée est saturé en sel, on peut donc calculer la solubilité du sel dans l'eau : 40g/100ml soit 200g/L (environ)
Est-ce qu'il y a un intérêt à calculer la solubilité ? Puisqu'on a observé la saturation après avoir ajouté 10g, peut être que ce n'est pas au bout de 40g qu'il y a eu la saturation mais avant ?
Aussi, quel devrait être le temps trouvé ? Comment va-t-il évoluer ? Est-ce qu'il va augmenter car la solution va mettre plus de temps à dissoudre le sel puisqu'elle approche de la saturation ?
On observe après avoir secoué deux phases distinctes et donc une séparation entre la phase aqueuse et la phase d'éthanol. L'ajout de sel jusqu'à saturation provoque une démixtion de la phase aqueuse et de la phase d'éthanol
L'eau est miscible avec l'éthanol (tout deux des molécules polaires) et le sel se dissout très bien dans l'eau mais très mal dans l'éthanol. (je ne suis pas sûr de ça  Cependant, la solution d'eau salée étant saturé en sel, le sel va se mélanger à l'éthanol grâce au liant (l'eau).
Cependant, la solution d'eau salée étant saturé en sel, le sel va se mélanger à l'éthanol grâce au liant (l'eau).
Merci d'avance
Bonjour
Puisqu'on a observé la saturation après avoir ajouté 10g, peut être que ce n'est pas au bout de 40g qu'il y a eu la saturation mais avant ?
La solubilité est la masse maximale de NaCl que l'on peut dissoudre par litre de solution mais cela sans limitation du temps de dissolution. Tes expériences montrent que plus la quantité dissoute est grande, plus la durée nécessaire à la dissolution est grande mais cela n'intervient pas dans la définition de la solubilité. Il n'y a pas de saturation pour 10g de sel introduit par litre car , avec un peu de patience et en agitant le flacon, la totalité du sel se dissout. Même chose pour 20g/L et pour 30g/L. En revanche, à partir de 40g de sel ajouté par litre, on a beau être patient et agiter, du solide reste toujours en équilibre : la solution est saturée. La solubilité est donc supérieure à 30g/L et inférieure à 40g/L. Des mesures plus précises conduisent à une solubilité de 36g/L à 25°C.
D'accord merci pour votre réponse, je pense que la question 1 est (entièrement ?) répondu.
Que pensez-vous de la question 2 ?
Effectivement : la solubilité du chlorure de sodium est beaucoup plus faible dans l'éthanol que dans l'eau.
Si tu ajoutes une grande quantité de sel dans un mélange homogène eau-éthanol, il y a démixtion : l'éthanol se sépare de l'eau, le sel étant essentiellement soluble dans l'eau.
D'accord merci mais donc je me suis trompé en disant que le sel va se mélanger avec l'éthanol après démixtion ? Ce que j'ai dit me semble très loin des 20lignes demandés, je suis passé à coté de beaucoup de choses ?
Je ne pense pas que la notion de coefficient de partage soit à ton programme. Dans ces conditions, dire que le chlorure de sodium dissout se trouve presque totalement dissous dans l'eau dans la mesure où il est beaucoup plus soluble dans l'eau que dans l'éthanol ,me semble suffisant.
Ce que j'ai dit me semble très loin des 20lignes demandés, je suis passé à coté de beaucoup de choses ?
Je te fourni ici des pistes de réflexion et l'essentiel à retenir. Il te faudra développer en décrivant les résultats observés lorsque le TP sera fait. Etre précis et concis sera sûrement plus apprécié que de longs commentaires plus ou moins "copiés-collés" à partir d'internet !
D'accord je vous remercie pour votre réponse mais je crois que j'ai sauté une question ce qui rend le contenu des réponse encore plus petit, ceci est la réponse à la question 3 (et ca répond aussi un peu à la 2).
Pour la question 2, il suffit de dire que la solubilité du chlorure de sodium est beaucoup plus faible dans l'éthanol que dans l'eau ?
Oui mais, quand tu auras fait le TP, il faudra décrire les fait observés et expliquer comment ils conduisent logiquement à cette conclusion.
D'accord merci.
Pour la question 4, je fais le dosage et note le volume équivalent soit le moment où il y a un changement de couleur ou dois-je nécessairement faire un graphique ? Pour les deux solutions (?) : C(Ca(OH))2.V(Ca(OH))2=Cb.Ve1, C(Ca(OH))2=(Cb.Ve1)/V(Ca(OH))2
Ensuite, pour une mole de Ca(OH)2, on a une mole de Ca2+ et 2 moles de OH-
Donc : n(Ca(OH)2)=n(Ca2+)=n(OH-)/2
Donc C(Ca2+)=C(Ca(OH)2 Et C(OH-)=[C(Ca(OH)2]/2 ?
Il s'agit du dosage par les ions oxonium de l'acide chlorhydrique des ions hydroxyde de la solution d'hydroxyde de calcium. Il suffit je pense de noter les volumes équivalents en expliquant pourquoi l'équivalence correspond au virage du bleu au jaune du bleu de bromothymol.
Il faudrait aussi rappeler l'équation de la réaction de dosage puis adapter les notations.
L'équivalence correspond avec les notations classiques à :
cb.vb=ca.vae
où cb représente la concentration en ions hydroxyde dans la solution d'hydroxyde de calcium. Je te laisse trouver la signification des autres notation. La concentration en hydroxyde de calcium est c=cb/2 (à justifier)...
On a un virage du bleu au jaune car le Ca(OH)2 est dosé par le HCL ?
Ca(OH)2 +HCL -> CaCl2 + H2O ?
cb.vb=ca.ve
cb=(ca.ve)/vb
vb : Volume de solution d'hydroxyde de calcium
ca : Concentration en ions oxonium = 0,05 mol/L
ve : Volume d'acide chlorhydrique
La concentration en hydroxyde de calcium est c=cb/2 car Ca(OH)2 <-> Ca2+ + 2OH- donc on a 2 mole de d'ions hydroxyde pour 1 mole d'hydroxyde de calcium.
La concentration en Ca2+ est donc c(Ca2+)=c=2cb ?
L'équation de la réaction de dosage fait intervenir des ions en solution. Inutile de faire figurer les autres espèces. D'où l'équation :
HO- + H3O+  2H2O
2H2O
Tu as mal lu mon message précédent sur la relation entre cb et c. Une mole d'ions hydroxyde en solution est obtenue par la dissolution d'une demie mole de Ca(OH)2.
Oui pour ta dernière phrase. La solution contient effectivement deux fois moins d'ions calcium que d'ions hydroxyde.
D'accord donc je résume :
HO- + H3O -> 2H2O
cb.vb=ca.ve
cb=(ca.ve)/vb
vb : Volume de solution d'hydroxyde de calcium
ca : Concentration en ions oxonium = 0,05 mol/L
ve : Volume d'acide chlorhydrique
Une mole d'ions hydroxyde en solution est obtenue par la dissolution d'une demie mole de Ca(OH)2 donc c(Ca2+)=cb/2
On peut maintenant comparer entre les deux solutions. Je suppose que les concentrations vont être différentes et la concentration en Ca2+ plus grande dans la solution avec CaCl2 ?
Pour bien comprendre l'effet d'ions communs, il faut quelques notions sur les équilibres chimiques et les constantes d'équilibre. La notion de produit de solubilité : tu connais ?
Non mais j'ai un cours sur la solubilité que l'on a pas encore commencé et qui sera vraisemblablement fait quelques temps après le TP.
j'ai un cours sur la solubilité que l'on a pas encore commencé et qui sera vraisemblablement fait quelques temps après le TP.
Difficile de t'aider efficacement maintenant sans connaître les exigences de ton programme ! Quelques pistes de réflexion quand même concernant l'effet d'ion commun.
Suppose une solution saturée d'hydroxyde de calcium. Il y a équilibre chimique entre le solide non dissout et les ions de la solution. Cet équilibre correspond à l'équation :
La concentration en hydroxyde de calcium dissout, que l'on note "c" dans le cas général mais que l'on note "s" comme solubilité dans le cas particulier de la saturation, vérifie :
Suppose que tu ajoutes maintenant une solution contenant un des deux types d'ions de la solution saturée précédente : ions hydroxyde ou ions calcium mais dans ton expérience ce sont des ions calcium. L'apport d'ions calcium va modifier l'équilibre précédent en favorisant la réaction consommant des ions calcium donc la réaction dans le sens droite
 gauche produisant ainsi davantage de solide et entraînant une diminution de [HO-]. Conclusion : la solubilité
gauche produisant ainsi davantage de solide et entraînant une diminution de [HO-]. Conclusion : la solubilité Remarque 1: il n'est plus possible d'écrire
Remarque 2 : l'effet d'ion commun pourrait être obtenu en remplaçant le chlorure de calcium par une solution contenant des ions hydroxyde, une solution de soude : l'hydroxyde de calcium est moins soluble dans une solution de soude que dans de l'eau pure.
Si j'ai bien compris, avec le chlorure de calcium la concentration en HO- est moins élevé pour la raison que vous avez expliqué mais pour le Ca2+, la concentration sera plus élevé en raison car il y aura des ions Ca2+ supplémentaire grâce au chlorure de calcium ?
Oui mais le plus important à retenir est que l'ajout d'ions calcium ou hydroxyde diminue la solubilité de l'hydroxyde de calcium. C'est l'effet d'ion commun.
D'accord merci, et concernant la raison du virage du bleu au jaune, ca a lieu au volume équivalent qui correspond au dosage des ions hydroxyde par les ions oxonium ?
Oui. Le BBT est particulièrement adapté au dosage base forte - acide fort. En effet le BBT vire du bleu au jaune entre pH=7,6 et pH=6. Le pH à l'équivalence, pour un dosage base forte -acide fort vaut 7, valeur appartenant à la zone de virage. De plus : ce sont deux couleurs faciles à différentier. Au voisinage de l'équivalence, la courbe pH=f(va) est quasi verticale, ce qui permet une détermination du volume équivalent à la goutte près.
Attention : la courbe ci-dessous est fournie pour rappeler l'allure de la courbe pH=f(va) et le comportement du BBT mais les valeurs numériques sont choisies totalement au hasard...
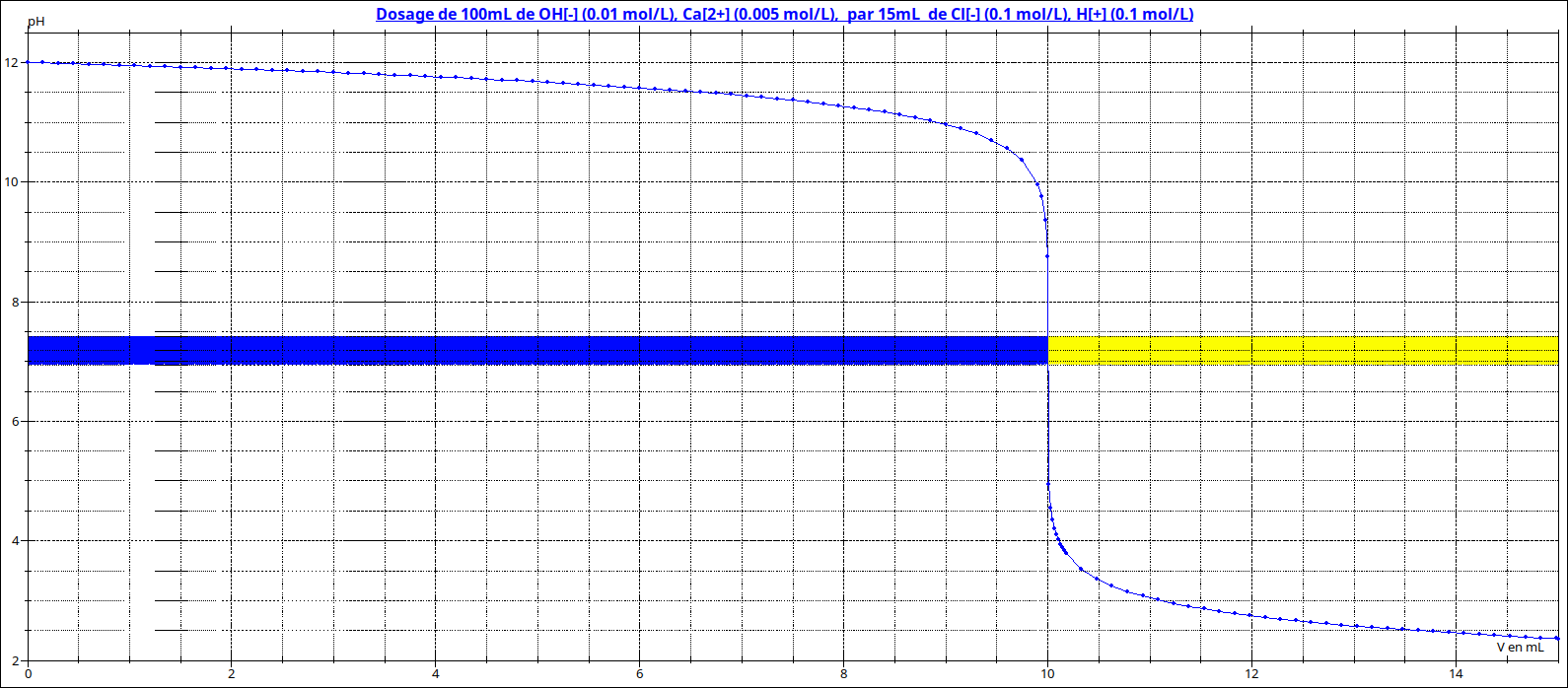
D'accord merci,
Pour la question 5 :
On observe, après ajout de soude, un précipité bleu (même après agitation ?). Après ajout de NH3, a-t-on un autre précipité ou plusieurs phases ?
Laisse moi deviner : on te demande paragraphe 3 d'étudier l'influence de la formation de complexes sur la solubilité sans avoir eu le moindre cours sur la solubilité des solides et sur les complexes... C'est bien cela ?
Le cours que l'on étudie actuellement est sur les grandeurs, avancement et équilibre. J'ai déjà le cours sur la solubilité mais on ne l'a pas étudié en cours (raison pour laquelle je ne l'ai pas encore touché). Par contre je ne vois pas de cours sur la complication, le mot est écrit seulement deux ou trois fois. Peut être que l'on attendez de nous qu'on lise le cours sur la solubilité nous même ? Ou alors il y aura bien plus d'explications pendant le TP ? Mais nous avons tous ce mêmeTP a des semaines différentes par groupe
Ces fameux "TP tournants"... Juste quelques indications...
L'hydroxyde de cuivre(II) est un solide bleu très peu soluble dans l'eau. Si on mélange des ions cuivre(II) et des ions hydroxyde, la solution sature : on obtient un équilibre chimique entre le solide (on peut aussi dire : le précipité) et les ions, analogue à celui rencontré avec l'hydroxyde de calcium :
Supposons que l'on ajoute alors une solution d'ammoniac (cette solution est parfois appelée ammoniaque), il se produit alors une réaction de complexation produisant des ions tétraamminocuivre(II) de couleur bleue :
Cette complexation, en consommant des ions Cu2+, déplace l'équilibre de précipitation précédent dans le sens gauche  droite et, à partir d'une certaine quantité d'ammoniac ajoutée, le précipité disparaît totalement : il n'y a plus d'hydroxyde de cuivre(II) mais une solution parfaitement limpide dont la couleur bleue est imposée par la présence des ions complexes en solution
droite et, à partir d'une certaine quantité d'ammoniac ajoutée, le précipité disparaît totalement : il n'y a plus d'hydroxyde de cuivre(II) mais une solution parfaitement limpide dont la couleur bleue est imposée par la présence des ions complexes en solution .
L'essentiel à retenir : l'hydroxyde de cuivre(II) est extrêmement peu soluble dans l'eau mais très soluble dans une solution d'ammoniac à cause de la formation d'ions complexes tétraamminocuivre(II).
D'accord merci de votre réponse,
Ces fameux "TP tournants"...
Oui ou alors le cours a été fait durant mes quelques absences mais j'en doute très fortement car le cours que l'on fait actuellement (le premier) contient l'introduction de la matière (l'explication du déroulement du semestre)...
Pour la question 6, lorsque l'on met quelques gouttes de NaOH, on a : Al3+ + 3OH- <-> Al(OH)3
Al(OH)3 est insoluble dans l'eau, on obtient comme dans le cas prédecent un équilibre chimique entre les ions et le précipité car la solution sature ?
En rajoutant de la soude, Al(OH)3 permet d'obtenir la complexation : Al(OH)3 + OH- <-> [Al(OH)4]-
Conclusion : L'augmentation du ph (en ajoutant de la soude) modifie la solubilité ? Dans ce cas, il augmente la solubilité (dans une solution de soude) grâce à la création du complexe (car comme on l'a démontré à la question précédente, la formation du complexe a augmenté la solubilité).
Les complexes n'interviennent pas ici. As-tu entendu parler d'hydroxyde amphotėre comme l'hydroxyde d'aluminium ou l'hydroxyde de zinc ?
C'est cela : Al(OH)3 peut se comporter en base en réagissant sur les acides à pH faible pour donner des ions aluminium(III) :
il est donc très soluble à pH faible.
Il peut également se comporter en acide à pH élevé en réagissant sur les ions hydroxyde pour former un ion complexe tétrahydroxoaluminate(III) :
Il est donc très soluble également à pH élevé.
La solubilité de l'hydroxyde d'aluminium(III) varie donc avec le pH et présente un minimum à pH moyen (5,5 environ) comme le montre la courbe que j'ai eu l'occasion de présenter ici :
![]() l'aluminium, hydroxyde amphotère
l'aluminium, hydroxyde amphotère
Pour revenir à ton TP : tu devrais maintenant être capable de prévoir ce qui se passe quand, à une solution incolore et limpide de nitrate d'aluminium (totalement soluble) à pH faible, on ajoute goutte à goutte, lentement, de la soude assez concentrée.


