Inscription / Connexion Nouveau Sujet
l'aluminium, hydroxyde amphotère
Bonsoir,
J'ai des problèmes avec un exercice concernant la précipitation. Voici son énoncé :
Données : pHs [Al(OH)3]=33
Al(OH)3(s) + HO-=[Al(OH)4]- K°=40
1. Une solution d'ions Al3+ de concentration égale à 1,0.10-2mol.L-1 en milieu acide est traitée par une solution de soude. Calculer le pH de début de précipitation.
Tout d'abord, je ne comprends pas comment faire pour trouver la réaction qui a lieu parce-qu'on nous dit toujours d'habitude qu'on est soit en milieu acide soit en milieu basique et qu'on ne mélange pas les H3O+ et les HO- mais ici on introduit des HO- dans un milieu avec des H3O+. Du coup, j'ai fait un bilan des espèces et j'ai trouvé la réaction suivante :
Al3++6 H2O=Al(OH)3+3H3O+
qu'on peut décomposer en deux réactions de constantes d'équilibres connues :
Al3+ + 3HO- = Al(OH)3
6 H2O= 3 H3O+ + 3 HO-
sauf que comme d'habitude c'est faux et je ne comprends pas pourquoi.....
Dans le corrigé, il y a écrit que la réaction est tout simplement : Al3+ + 3HO- = Al(OH)3 mais dans ce cas-là, à quoi cela sert-t'il de nous dire qu'on est en milieu acide ??????
Le corrigé de la 2e question me pose aussi problème mais je pense que le principe est similaire :
2. En milieu basique, le précipité se dissous par formation de l'ion tétrahydroxyaluminate. Calculer le pH de fin d'existene du précipité et tracer le diagramme d'existence de Al(OH)3 en fonction du pH.
Dans la correction il y a écrit : Al(OH)3(s) + HO-=[Al(OH)4]-
Pourquoi ?
3. Quel est le pH pour lequel la solubilité est minimale ?
Dans la correction il y a écrit s=Al3++[Al(OH)4]-
Est-ce que c'est encore un problème de conservation de matière ???
Ensuite il y a écrit que la solubilité est minimale si ds/dh=0
Pourquoi ? Est-ce que cela a un rapport avec une courbe ou quelque chose comme ça ?
Merci d'avance pour vos explications !
Bonsoir
Il faut imaginer une solution contenant initialement 10-2mol/L d'ions aluminium. Sans variation de volume appréciable, on imagine pourvoir régler le pH à une valeur quelconque, par exemple en dissolvant du chlorure d'hydrogène gazeux pour le faire diminuer, en ajoutant des cristaux de soude pour l'augmenter. Tu considères donc h=10-pH comme une donnée, sans te préoccuper de la façon dont cette valeur est obtenue.
Cela devrait t'aider à mieux comprendre ton corrigé...
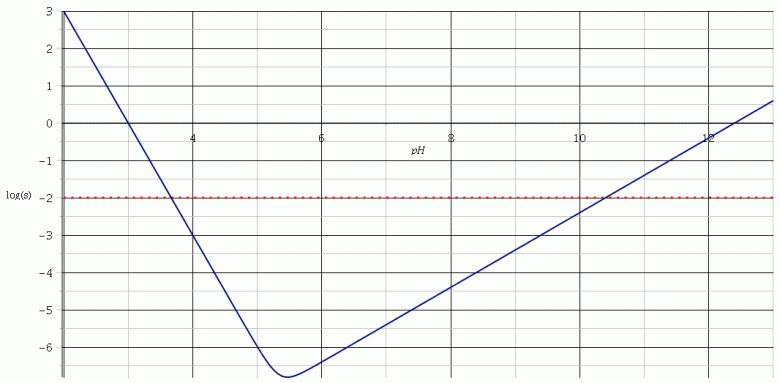
Pour illustrer la situation, voici la courbe représentant les variations en fonction du pH du logarithme décimal de la solubilité s.
On voit clairement que la solubilité présente un minimum.
J'ai rajouté l'horizontale d'ordonnée log(c). On peut distinguer trois cas :
pH<3,7 : s>c : la solution peut dissoudre plus que la quantité maximale d'hydroxyde d'aluminium susceptible d'être présent. Il n'y a pas de précipité. La solution est limpide.
3,7<pH<10,4 : s>c : la solubilité est trop faible pour que tout le précipité soit dissout. Du précipité existe à l'équilibre.
pH>10,4 : s>c : pas de précipité.
Tu as sûrement réalisé en TP cette expérience : à une solution très acide de chlorure d'aluminium, tu ajoutes progressivement de la soude de façon à augmenter le pH. A partir d'un certain volume de soude ajouté, du précipité blanc d'hydroxyde d'aluminium apparaît. Si tu continues à ajouter de la soude, la quantité de précipité commence par augmenter, passe par un maximum puis diminue jusqu'à finir par disparaître par réaction de complexation à partir d'un certain pH.
Merci pour le graphique et les explications ça m'a aidé. En fait pour la question 1. le milieu acide sert à dire qu'on néglige la réaction Al(OH)3(s) + HO-=[Al(OH)4]- ? Aussi dans ton explication, pour le deuxième cas tu as écrit "3,7<pH<10,4 : s>c : la solubilité est trop faible pour que tout le précipité soit dissout. Du précipité existe à l'équilibre. " mais ce n'est pas plutôt s<c ?
Pas de souci 
J'ai essayé de voir pourquoi on avait s>c par le calcul mais je pense que je me trompe dans le calcule de s parce-que j'obtiens s<c ce qui est incohérent.
Pour pH=3,7 (pH du début de précipitation) la réaction est totale et le réactif limitant est HO- tel que [HO-]o=10-10,3 donc [Al3+]=10-3mol/L à l'état final. En fait je pense que je n'indentifie pas correctement qui est s parce-que dans le sens de dissolution, s correspond à l'avancement mais dans le sens de précipitation on fait comment ?
La solutilité s désigne la quantité maximale de précipité susceptible d'être dissout par litre de solution. Si tu préfères : c'est la quantité de précipité dissout par litre dans le cas particulier où la solution est en équilibre avec le solide.
La dissolution du solide produit soit des ions aluminium soit des ions aluminate. Donc :
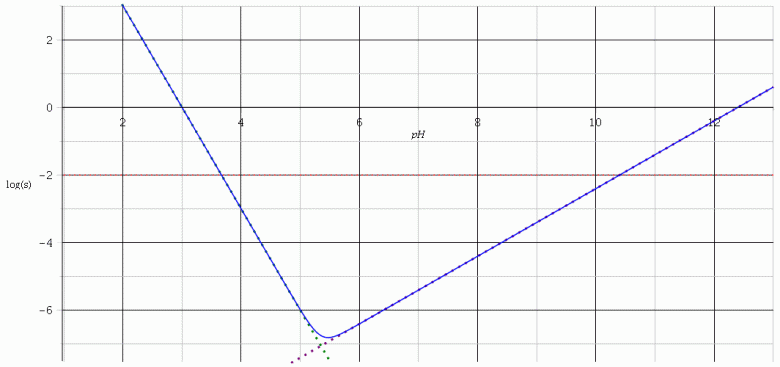
Je te laisse remplir un tableau d'avancement. Il est facile de montrer que, pour les pH inférieurs à la valeur correspondant au minimum de s, l'ion complexe est ultraminoritaire, la dissolution produit essentiellement des ions aluminium. Pour les pH supérieurs, c'est au contraire l'ion complexe qui est essentiellement produit par dissolution. Ces remarques permettent de fortement simplifier les calculs :
si
si
Pour illustrer cela, j'ai rajouté à la courbe précédente, les courbes (pointillé vert) et
(pointillé rose)
Je suis désolée mais je suis un peu perdue. En fait pour moi les deux réactions qu'on a sont quantitatives puisque leur constante d'équilibre est très supérieure à 103. Mais comment sait-on qui est le réactif limitant ?
Al 3+ + 3HO- = Al(OH)3(s)
10-2 ? 0
et ensuite il faudrait construire le tableau d'avancement pour la 2e réaction à partir du premier mais du coup on ne sait pas combien vaut [HO-] et s'il est limitant. Et si ces réactions sont quantitatives alors à quoi correspond s dans le tableau d'avancement ? Il ne devrait pas apparaître ?
En fait si la réaction serait dans le sens inverse j'arriverais à faire le tableau d'avancement mais dans ce sens-là je suis perdue alors que j'imagine que ce n'est pas tellement différent. Dans le sens indirect, si on considérerait qu'on a seulement du Al(OH)3(s) au départ (mais ce n'est pas le cas ici), on aurait :
Al(OH)3(s) = Al 3+ + 3HO-
no 0 0
no-s s 3s
Bonjour
Tu n'as pas bien compris mon message du 05-04-18 à 19:24. Il faut considérer ici le pH comme un paramètre ajustable par addition d'acide ou de base forte mais il n'est jamais demandé dans ce genre de problème de déterminer la manière dont la valeur du pH a été obtenue. Un tableau d'avancement est donc ici sans intérêt. On se contente de prendre en compte les équilibres chimiques...
En effet, je pense que je n'ai pas tout saisi. J'ai trouvé un autre exercice entre temps du même type. Du coup j'ai l'impression d'avoir un peu plus saisi le principe de ce type d'exo même si cela reste assez vague.
Voilà ce que j'ai cru comprendre (mais si c'est faux il faut me le dire) :
En fait, cela ressemble un peu à un titrage d'une espèce acido-basique amphotère. C'est un peu comme si on réalisait deux titrages successifs.
Dans le deuxième cas, on considère, un peu comme après la 2e équivalence d'un titrage acido-basique, que le Al(OH)3 est entièrement consommé et que HO- est introduit en excès. Du coup cela expliquerait pourquoi on obtient [Al(OH)4-=10-2mol.L-1
Par contre, pour le tableau d'avancement, je ne vois toujours pas comment faire avec le s....
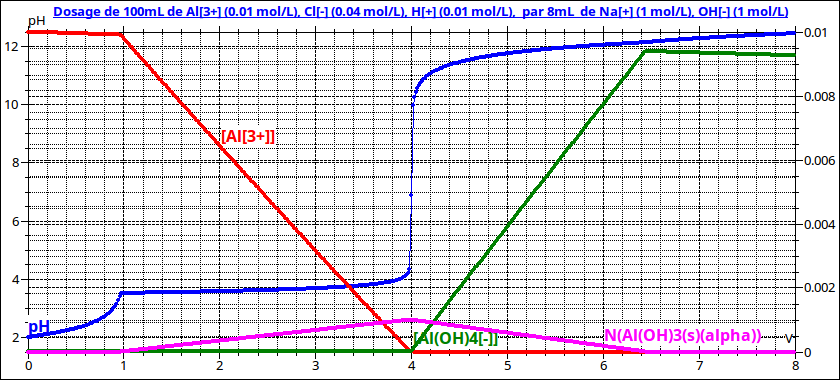
Pour t'aider un peu voici la courbe de titrage de 100mL de chlorure d'aluminium à 0,01mol/L par une solution de soude à 1mol/L. Pour bien mettre en évidence l'apparition du précipité, j'ajoute à la solution initiale de l'acide chlorhydrique de façon à obtenir un pH initial de 2.
0<Vb<1mL : dosage de l'acide chlorhydrique mais le pH n'atteint pas la valeur 7 à l'équivalence car dès qu'il atteint 3,7, la précipitation commence.
1mL<Vb<4mL : formation du précipité selon la réaction :
Al3++3HO- = Al(OH)3(s). Vb=4mL correspond à la quantité maximale de précipité avec un pH de l'ordre de 5,5
Pour Vb>4mL, la quantité de précipité diminue selon la réaction :
Al(OH)3(s)+HO- = Al(OH)4-
Attention K°=40 ; cette réaction ne peut pas être considérée comme quasi totale. Une partie des ions hydroxyde introduits restent en solution, d'où l'augmentation importante du pH que l'on observe. Il faut donc nettement plus de 1mL de soude ajoutée pour que la quasi totale des éléments aluminium soient présents sous forme d'ions Al(OH)4-.
Remarque : la valeur prise en compte de K° par le logiciel est un peu inférieure à 40, la valeur de ton énoncé...