Inscription / Connexion Nouveau Sujet
TP Dosage acide
Bonjour, je dois préparer un tp sur le dosage/titrage d'un acide mais je pense qu'il faut avoir fait le TP pour répondre aux questions mais dans le même temps, il est dit que l'on aura une interrogation en début de séance sur la préparation sur le TP. J'aurai donc besoin de votre aide afin d'être prêt pour le TP et l'interrogation.
Voici deux fichiers pdf, un fichier contenant le TP et un autre avec des informations communes à tous les TPs.
Donc tout d'abord ai-je bien compris ce qu'il faut faire ? :
1)Pour commencer le TP, je dilue chaque solution de vinaigre séparément avec de l'eau distillée(?), de sorte à avoir 10ml de vinaigre pour 90ml d'eau distillée (dans une fiole de 100ml)
2)Ici je n'ai pas compris :Je mets directement dans l'erlenmeyer 3 gouttes d'hélianthine ou de phénolphtaléine. Mais dans l'une des deux solution, de l?hélianthine et dans l'autre de la phénolphtaléine ou les deux dans deux ? Si oui, je me retrouverai avec 4 erlenmeyer différents ? 2 erlenmeyers avec une première solution de vinaigre et les deux indicateurs différents et 2 erlenmeyers avec une deuxième solution de vinaigre et deux les indicateurs différents ?
3) je mets dans la burette du NaOH et je verse petit à petit pour faire les 3 mesures (mais quelle est le volume à verser ? Jusqu'à équivalence, donc changement visible ?), pour chaque erlenmeyer avec les solutions de vinaigres différents ?
On nous redemande ensuite d'autres mesures pour la question 1 ?
Merci d'avance
** Fichier supprimé **
** Fichier supprimé **
règles du forum non respectées, à lire : ![]() [lien]
[lien]
Bonjour
Pour faciliter l'archivage par les moteurs de recherche, il te faut recopier les cinq premières lignes du document de présentation du TP. Tu pourras alors redonner les liens des fichiers.
J'ai totalement oublié, désolé ! Voici :
But de la séance de TP :
Le vinaigre de vin est obtenu par oxydation de l'éthanol du vin par l'oxygène de l'air, en
présence d'une bactérie qui catalyse la réaction :
CH3CH2OH + O2 = CH3COOH + H2O
Le vinaigre est donc une solution aqueuse d'acide éthanoïque (ou acide acétique). Sur une
bouteille commerciale, le fabricant fournit une indication en degré. Un degré correspond à 1g
d'acide pour 100 g de solution de vinaigre. Généralement le vinaigre blanc est donné à environ
8degrés.

PDF - 255 Ko

PDF - 151 Ko
A ce que je comprends : tu as deux solutions : une d'acide éthanoïque, l'autre contenant un mélange acide chlorhydrique acide éthanoïque. Chacune de ces solution doit être dosée deux fois : une fois avec l'hélianthine, une fois avec la phtaléine ; cela fait donc quatre dosages en tout. Surtout ne pas mélanger les indicateurs colorés !
Voici les courbes pH=f(Vsoude) dans le cas du mélange acide fort acide faible. Tu as deux équivalences successives : une première correspondant à la disparition de l'acide fort ; elle se produit à pH acide et est détectée par le virage de l'hélianthine. Une seconde correspondant au dosage à la fois de l'acide fort et de l'acide faible. Elle se produit en milieu basique et correspond au virage de la phtaléine. Voir courbes ci-dessous.
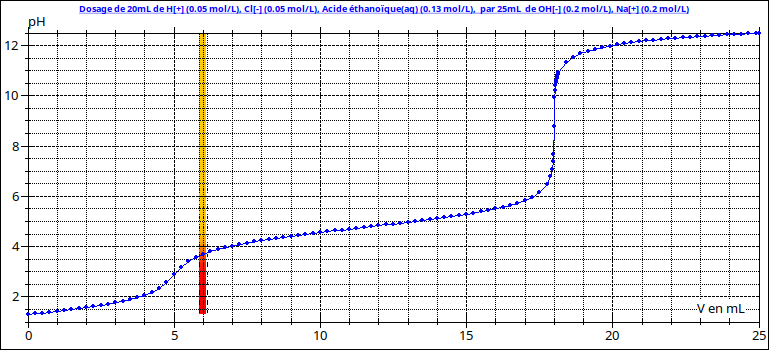
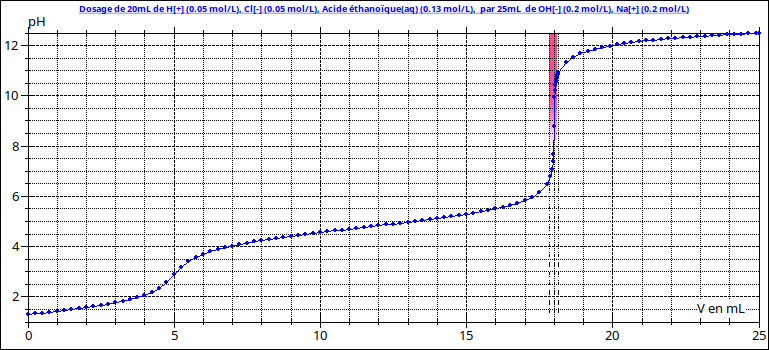
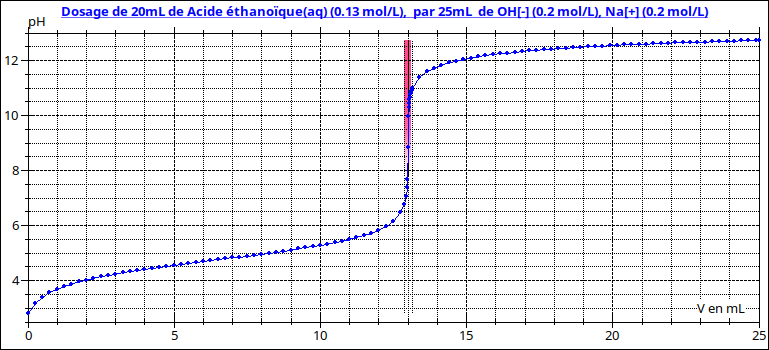
Voici la courbe correspondant au dosage du vinaigre seul. Je te laisse tirer les conclusion sur l'usage des indicateurs...
Merci pour votre réponse, si j'ai bien compris vos deux premières courbes correspondent a la solution contenant un mélange acide chlorhydrique acide éthanoïque avec l'indicateur d'hélianthine ?
Pour la question 1) il est écrit « avant et après l'équivalence » équivalence est au singulier donc il ne devrait y avoir qu'une seul équivalence non ?
Autre problème, avant la question 1, on ne parle pas de phmetre, « Effectuer 3 mesures du volume de NaOH nécessaire », à faire avec ou sans le pH mètre ? Car on dirait qu'il faut l'utiliser que pour le vinaigre frelaté.
Pour ce qui est des conclusions a en tirer, je ne sais pas, je suppose que ça « encadre » entre deux équivalences successives ?
Il ne s'agit pas de faire ici une étude pHmetrique. N'empêche : ces courbes sont là pour visualiser le virage de chaque indicateur : helianthine pour la première courbe, la phtaleine pour la deuxième. As-tu étudié cela en cours ? Pourquoi la fiche fournit elle les pKa des deux indicateurs ? Impossible de bien comprendre un TP sans avoir au préalable étudié et compris le cours correspondant.
D'accord merci, je n'ai pas encore fait le cours (ils sont parfois en différé par rapport aux TPs), mais je crois savoir ce que sont les pka.
Donc si j'ai bien compris la première étape du TP consiste à verser du NaOH dans 4 erlenmeyer différents avec deux indicateurs différents séparés pour les deux solutions. On devrait observé pour les deux solution, une équivalence pour l'hélianthine après avoir versé 6ml de NaOH et après 18ml pour la phénolphtaléine ? Puis on fait l'équivalence du vinaigre frelaté seul mais cette fois avec phmétrie ?
Moi qui pensais que les bandes colorées ajoutées sur les courbes illustraient bien le virage des indicateurs colorés ! 
L'hélianthine vire du rouge au jaune au voisinage de pH=pKa=3,9 alors que la phtaléine vire de l'incolore au violet au voisinage de pH= pKa=9,0.
Imagine du vinaigre non frelaté : c'est le cas de la troisième courbe. L'équivalence correspond au virage de la phtaléine de l'incolore au violet. L'équivalence, pour du vinaigre à 8°, se produira pour un volume de solution de soude d'environ 13mL.
Lors du dosage du vinaigre non frelaté en présence d'hélianthine, l'hélianthine virera du rouge au jaune au voisinage de pH=3,9 : ce virage ne correspond à rien de particulier ; le volume de soude ajouté pour obtenir le virage n'a aucun intérêt ici.
Imagine maintenant du vinaigre frelaté soit un mélange d'acide éthanoïque et d'acide chlorhydrique. Le saut de pH correspondant au dosage de l'acide chlorhydrique se produit au voisinage de 3,9. Le volume de soude correspondant au virage d'hélianthine permet donc de connaître la concentration en acide chlorhydrique.
Attention : j'ignore la concentration en acide chlorhydrique dans ton TP. Ce virage ne se produira pas nécessairement au voisinage de 5mL comme sur la courbe n° 1. Le deuxième saut de pH correspond sensiblement au virage de la phtaléine. Le volume de soude permet de trouver la somme des deux concentrations : celle en acide chlorhydrique et celle en vinaigre. Par différence avec le volume au virage de l'hélianthine, tu obtiens le volume nécessaire au dosage du vinaigre seul.
D'accord merci, mais je ne comprend pas en quoi ca permet de déterminer le vinaigre frelaté ? J'ai compris que l'on regarde en fonction de si le saut de ph se produit au moment du virage de la phtaléine ou de l'hélianthine. Mais le vinaigre frelaté sera celui avec le saut de ph avec l'hélianthine ou la phtaléine ?
Ensuite, le jour du TP je ne pourrais pas observer le saut de ph pour les 4 erlenmeyers, c'est seulement après pour le tracage de la courbe ?
Si tu pars d'une solution acide quelconque de pH inférieur à 3 et que tu augmentes progressivement le pH en ajoutant de la soude, tu auras toujours un virage de l'hélianthine au environ de 3,9 et un virage de la phtaléine au voisinage de 9. Encore faut-il que ces virages correspondent à quelque chose d'intéressant : la fin de réactions de titrage par exemple. Dans trois cas sur 4, c'est le cas ici puisque le virage de l'hélianthine avec le vinaigre non frelaté ne correspond à rien de particulier. J'ai expliqué tout cela en détail dans mon précédent message.
je ne comprend pas en quoi ca permet de déterminer le vinaigre frelaté
Le vinaigre frelaté est du vinaigre auquel on a ajouté de l'acide chlorhydrique pour le rendre plus acide, ce qui permet de le vendre plus cher. J'ai déjà expliqué qu'un vinaigre non frelaté de 8° conduisant à un virage de la phtaléine à 13,3mL de soude environ. Pour le vinaigre frelaté, son acidité totale est plus forte, le virage de la phtaléine interviendra pour un volume de soude plus élevé. Pour ce vinaigre frelaté, le virage de l'hélianthine permet d'obtenir aussi la concentration en acide chlorhydrique comme déjà expliqué.
L'étude des courbes pH=f(Vsoude) permet directement de trouver le vinaigre frelaté : vinaigre frelaté : deux sauts de pH ; vinaigre non frelaté : un saut de pH.
Cependant, l'étude préalable à l'aide d'indicateur coloré présente une utilité : elle permet de prévoir en bonne approximation les sauts de pH. Lorsque l'on réalise l'étude pHmétrique, on peut ainsi rapprocher les points de mesures aux voisinages des équivalences où les variations de pH sont rapides et espacer les points de mesures lorsque les variations de pH sont lentes.
D'accord merci, quelle formule pour le calcul de la concentration doit être utilisé ? On a déjà 4 volumes équivalents, il nous faudrait maintenant la quantité de matière pour utiliser c=n/V mais comment ? ou une autre formule ?
Aussi, est-ce que vous pourriez me dire en quelques mots ce qu'il faudra faire pour les questions 3 et 4 et ce que je suis censé trouver s'il vous plait ?
Le premier saut de pH correspond au dosage de l'acide chlorhydrique pour un volume Ve1 de soude de concentration Cb. Si Ca est la concentration en acide chlorhydrique :
Ca.Vvinaigre=Cb.Ve1.
Vvinaigre désigne le volume de vinaigre frelaté utilisé.
Le deuxième saut de pH correspond au dosage de l'acide éthanoïque (vinaigre). A la deuxième équivalence, les deux acides ont donc été dosés. Si on note Cv la concentration en vinaigre (acide éthanoïque) et Ve2 le volume de soude versé au deuxième saut de pH :
[Ca+Cv].Vvinaigre=Cb.Ve2
Une soustraction "membre à membre" conduit à :
Cv.Vvinaigre=Cb.(Ve2-Ve1)
Si j'ai bien compris (je sais, je suis trop lent à comprendre...) pour le vinaigre frelaté on observe deux sauts de ph qui correspondent au dosage des deux acides (acide chloridrique et acide éthanoïque), d'hélianthine correspond au dosage chloridrique et phénolphtaléine au dosage de l'acide éthanoïque
Le vinaigre frelaté n'étant pas un mélange de plusieurs acides, un seul saut de ph utile, pas d'acide chloridrique le saut pour l'hélianthine ne veut pas dire grand chose, mais le second avec la phénolphtaléine correspond au dosage de l'acide éthanoïque comme pour le vinaigre frelaté ?
Comment savez-vous que le premier saut de ph est pour l'acide chlorydrique ? Car il est plus acide ? C'est quelque chose à savoir ?
Tu résumes assez bien la situation. Ton deuxième paragraphe concerne le vinaigre non frelaté mais l'absence du "non" est sûrement une étourderie.
Troisième paragraphe. On observe deux sauts de pH quand les constantes d'équilibres des réactions de dosages sont très grandes devant 1 et lorsque la première est au moins 104 fois plus élevée que la seconde. La constante de la réaction acide fort -base forte est nettement plus élevée que la constante de la réaction acide faible-base forte. C'est donc l'acide chlorhydrique qui réagit en premier. J'ai eu l'occasion il y a quelque temps d'écrire un document sur ce sujet. Le niveau général dépasse à mon avis les exigences de ton programme mais tu peux sans doute t'intéresser aux étapes 1, 2 et 4.
![]()
Merci.
Par rapport à vos calculs, la raison pour laquelle il faut faire cette différence, c'est parce qu'il y a plusieurs acides qui sont dosés ? Si on travail avec le vinaigre non frelaté, il n'y a qu'un seul acide, donc forcément un seul de dosé donc forcément cette formule Ca.Vvinaigre=Cb.Ve2 ?
D'accord merci !
Donc pour répondre (en partie) à la question 1 avec toutes les réponses que vous avez donné :
On aura mesuré 4 volumes équivalents, 4 changements de couleurs (enfin deux fois deux changements pareils), on aura 3 (?) concentrations différentes :
Cvinaigre(vinaigre non frelaté) : Ca=(Cb.Ve2)/Vvinaigre
CHCL(vinaigre frelaté) : Ca=(Cb.Ve1)/Vvinaigre
Cvinaigre(vinaigre frelaté) : Cv=(Cb.(Ve2-Ve1))/Vvinaigre
Les trois Vvinaigre correspondent aux 20ml initiaux dans le bécher, ou au volume du bécher moment de l'équivalence (donc 20ml+Soude versé)?
D'accord merci, si cette première partie est correcte, ensuite :
La solution de vinaigre frelaté est la solution contenant de l'acide chlorhydrique car "son acidité totale est plus forte, le virage de la phtaléine interviendra pour un volume de soude plus élevé." c'est à dire que l'équivalence pour la phénolphtaléine interviendra plus tard
Pour les incertitudes, je crois qu'il faut se servir dur tableau du document annexe mais les incertitudes de quoi ? De la burette ? De l'erlenmeyer ou encore du bécher utilisé pour diluer ?
Il s'agit a priori de trouver les trois incertitudes absolues sur la concentration du vinaigre non frelaté puis la concentration en acide chlorhydrique et la concentration en vinaigre dans le vinaigre frelaté.
Compte tenu des formules de calcul de ces concentrations, chaque incertitude relative apparaît comme la somme de trois incertitudes relatives. Pour celles sur les volumes : se référer au document n° 1 que tu as fourni. Problème : l'incertitude sur la concentration cb de la solution de soude n'est pas fournie. Elle le sera sans doute lors de la séance de TP.
Est-ce que ces trois formules sont correctes ? :
Cvinaigre(vinaigre non frelaté) : Ca=(Cb.Ve2)/Vvinaigre
Donc deltaCvinaigre = Cvinaigre ( deltaCb/Cb + deltaVe2/Ve2 + deltaVvinaigre/Vvinagire)
CHCL(vinaigre frelaté) : Ca=(Cb.Ve1)/Vvinaigre
Donc deltaCa = Ca ( deltaCb/Cb + deltaVe1/Ve1 + deltaVvinaigre/Vvinagire)
Cvinaigre(vinaigre frelaté) : Cv=(Cb.(Ve2-Ve1))/Vvinaigre
Donc deltaCv = Cv ( deltaCb/Cb + [(deltaVe1 + deltaVe2)/(Ve2-Ve1)] + deltaVvinaigre/Vvinagire)
Est-ce correcte ?
Merci, je n'arrive pas à savoir les valeurs numériques des delta (sauf deltaCb à voir le jour du TP)
Les 20mL de vinaigre utilisés peuvent être prélevés en une seule fois à l'aide d'une pipette de 20mL. Selon la fiche :
 Vvinaigre=0,03mL
Vvinaigre=0,03mL
Les volumes de soude aux différentes équivalences sont mesurés à l'aide de la burette. L'incertitude absolue minimale correspond à 0,05mL selon ton document. Cela dit, il faut aussi tenir compte du fait que la couleur de l'indicateur ne passe pas nécessairement d'une goutte à l'autre de soude ajoutée de l'incolore au rose violet pour la phtaléine ou du jaune au rouge pour l'hélianthine. Le changement de couleur peut être plus progressif d'où la difficulté de bien repérer le virage. Personnellement, pour tenir compte de cette difficulté, je prendrais 0,1mL...
Donc selon vous, deltaVe1=deltaVe2=0,05ml+0,1ml=0,15ml=0,2ml ?
Ca ne devrait pas être plutôt : deltaVe1= moyenne des trois mesures de Ve1 - mesure avec le plus écart avec la moyenne + 0,05ml ?
Pour les volumes équivalents,le plus simple est effectivement d'utiliser le fait que chaque mesure est effectuée trois fois mais aucune raison de rajouter 0,05ml. Il ne faut pas mélanger les deux méthodes de détermination des incertitudes.
Donc j'ai deux méthodes : deltaVe1=deltaVe2=0,05ml+0,1ml=0,15ml=0,2ml
Ou
deltaVe1= moyenne des trois mesures de Ve1 - mesure avec le plus écart avec la moyenne
La seconde méthode tiendra peut-être mieux compte de l'incertitude lié à l'indicateur coloré. Je te conseille de faire les deux calculs et de comparer.
Merci et par rapport à ce que vous avez dit précédemment, le changement de couleur ne sera pas instantané ? Donc pour les volumes equivalents, ce sera du à peu près ?
Aussi, pour la question 3, il suffira de prendre les deux endroits où les points sont le plus rapprochés pour avoir les deux volumes équivalents (enfin s'il y en a que deux?) ? En faisant deux fois la méthode avec les tangentes ?
il suffira de prendre les deux endroits où les points sont le plus rapprochés pour avoir les deux volumes équivalents (enfin s'il y en a que deux?) ?
La méthode la plus rigoureuse consiste à considérer que les points d'équivalence correspondent aux maxima de la courbe dérivée
En faisant deux fois la méthode avec les tangentes ?
Décidément : les vieilles habitudes ont la vie dure ! Cette méthode est abandonnée par (presque) tout le monde ; elle est soit fausse soit inutile....
D'accord merci, une fois les volumes équivalents déterminés, est-ce que je dois utiliser ces deux formules pour l'acide chlorhydrique et l'acide éthanoique ?
CHCL(vinaigre frelaté) : Ca=(Cb.Ve1)/Vvinaigre
Cvinaigre(vinaigre frelaté) : Cv=(Cb.(Ve2-Ve1))/Vvinaigre
Oui. Tu pourras aussi comparer les résultats obtenus par pHmetrie et à l'aide des indicateurs colorés.
Une fois que j'ai les deux concentration, il est écrit « non dilué ». Est-ce que je dois faire Cv et CHCL multipliés par 10 ?
Merci, et pour la dernière question, je ne sais pas.
Utiliser la formule de la concentration massique ou la relation qui lie la concentration massique à la concentration en quantité de matière ? Mais avec quelle volume ? Quelle concentration utiliser ?
Parler de concentration sans plus de précision sous-entend concentration molaire.
Cependant,question 4, trouver le degré du vinaigre revient à déterminer la concentration massique. Cela est expliqué dans ton document.
Pour le vinaigre non frelaté, il n'y a pas d'ambiguité.
Pour le vinaigre frelaté : il faut avoir à l'esprit qu'il s'agit d'une "fraude" du fabriquant qui veut faire croire qu'il y a davantage de vinaigre qu'en réalité en ajoutant de l'acide chlorhydrique, beaucoup moins coûteux à obtenir que l'acide éthanoïque. Les fraudeurs définissent donc le degré de leur vinaigre frelaté à partir de l'acidité totale en faisant croire qu'elle est due uniquement à de l'acide éthanoïque. Pour justifier un "degré" élevé à leur vinaigre frelaté, Ils définissent donc une concentration massique qui n'a pas de véritable sens par :
C[sub]m[/sub]=(Ca+Cv).M où M est la masse molaire de l'acide éthanoïque. (voir dans mes messages précédents la signification de mes notations)
Donc on reprend les Ca et Cv déterminés à la question précédente,
Pour le degrés vinaigre frelaté non dilué : Cm=(Ca+Cv).M, M=60g/mol
Pour le véritable degré du vinaigre
(concentration en acide acétique seulement) : Je ne sais pas, j'ai essayé d'utiliser cette formule et je suis passé de ça Cv.Vvinaigre=Cb.(Ve2-Ve1) à ça : Cv=mb/Mb/Vvinaigre
Cv.Vvinaigre=Cb.(Ve2-Ve1)
Oui et une fois connue l concentration molaire, tu obtiens facilement la concentration massique et donc le degré du vinaigre non frelaté. Tu devrais obtenir une valeur proche de 8°.
Je ne suis pas sur d'avoir compris,
Pour le véritable degré du vinaigre c'est donc bien cette formule : Cv.Vvinaigre=Cb.(Ve2-Ve1) mais il faut arriver à quelque chose de la forme Cm=...
M=60g/mol aussi ?
J'aurai donc le premier Cm, Cmv
Et pour le vinaigre non frelaté, c'est écrit dans l'énoncé donc pas besoin d'utiliser des valeurs expérimental, on a dans le TP, 1g d'acide pour 100g qui correspond à 8 degrés. Et donc je compare Cmv à 8 degrés ? Et dire comme vous avez dit que c'est équivalent ?
1g d'acide pour 100g qui correspond à 8 degrés
Relis attentivement ton document et surtout : réfléchis avant de poster des questions dont la réponse est évidente...
Pardon, oui, ça signifie que le vinaigre blanc (c'est le vinaigre non frelaté?) correspond à 8g d'acide pour 100g qui correspond à 8 degrés.
Donc on aura Cmv= x g/L donc x grammes d'acide éthanoïque dans 1000ml de solution donc x/10 degrés ?



