Inscription / Connexion Nouveau Sujet
Thermodynamique
Bonjour à tous et merci de me lire
Je débute sur la thermodynamique et j'ai un soucis sur un énoncé s'il vous plaît
Une bombe calorimétrique de volume V contient n moles de gaz sous haute pression. Le gaz peut s'échapper lentement dans l'atmosphère (pression Po) à travers un tube capillaire. Le capillaire et la bombe se trouvent dans un récipient rempli d'eau et dans lequel est immergée une résistance électrique. Pendant que le gaz s'échappe lentement, un courant circule dans la résistance de sorte que le gaz, la bombe, el capillaire et l'eau restent à la température To de l'atmosphère.
Quelle est la variation d'énergie interne au bout d'un temps t, au cours duquel le maximum possible de gaz s'est échappé.
On appellera Vo le volume molaire du gaz sous la pression atmosphérique,  la différence de potentiel aux bornes de la résistance et i le courant qui passe dans cette résistance.
la différence de potentiel aux bornes de la résistance et i le courant qui passe dans cette résistance.
Quand on dit que le gaz s'échappe lentement quel effet cela a sur l'exercice s'il vous plaît ?Et si ça avait été rapide?
Bon j'ai un soucis dans la correction de cet exercice. Déjà il a été écrit que: Volume à l'état initial :V
Volume à l'état final: nVo
La détente s'effectue contre la pression extérieure Po, donc du travail W est fourni À l'extérieur tel que
W =-Po(nVo-V)
Alors là je ne vois pas quelle donnée de l'exercice nous permet d'affirmer que le volume final est nVo s'il vous plaît ?
Parceque Vo est le « volume du gaz sous la pression atmosphérique »
Et ensuite pour la chaleur il a été écrit :La chaleur fournie au sytème correspond à l'énergie électrique consommée par le circuit pour maintenir la température constante: Q= it d'où la variation d'énergie interne
it d'où la variation d'énergie interne  U=
U= it-Po(nVo-V)
it-Po(nVo-V)
Pourquoi Q correspond a cela s'il vous plaît ?
J'ai l'impression qu'on devine des choses mais ça doit être moi qui traduit mal l'énoncé
Merci beaucoup
Alors là je ne vois pas quelle donnée de l'exercice nous permet d'affirmer que le volume final est nVo s'il vous plaît ?
La pression finale est la pression atmosphérique. Dans l'état final, le volume molaire est donc Vo.
Quand on dit que le gaz s'échappe lentement quel effet cela a sur l'exercice s'il vous plaît ?
L'évolution est suffisamment lente pour être quasi statique.
Pourquoi Q correspond a cela s'il vous plaît ?
Le système formée du gaz et de l'eau est supposé isolé thermiquement de l'air atmosphérique. Sans apport de chaleur par effet Joule, la détente produirait un refroidissement.
d'accord si je comprends bien tout le gaz s'est échappé mais qu'est ce qui nous permet d'affirmer cela?
d'accord si je comprends bien tout le gaz s'est échappé
Non. Le gaz s'échappe tant que la pression dans le récipient reste supérieure à la pression atmosphérique extérieure. A l'état d'équilibre final, la pression à l'intérieur du récipient est égale à la pression atmosphérique.
Le volume finale n'est pas le volume final de gaz dans le récipient ?Quand je vois nV0 je me dis que finalement on a n mole de gaz sous la pression atmosphérique car V0 est le volume molaire de gaz sous la pression atmosphérique. Mon problème est qu'il y'a eu échappement de gaz pourquoi c'est le même nombre de mole n svp
Les lois de la thermo que tu as étudiées ne sont valides que pour un système formé d'une quantité fixe de matière : ici les n moles de gaz initialement occupant le volume V du récipient sous une pression inconnue mais nettement supérieure à la pression atmosphérique Po.
A l'état final ces n moles de gaz sont à la pression Po ; ce gaz a donc pour volume nVo et est réparti en deux. Une partie du gaz occupe le volume V dans le récipient, l'autre partie occupent le volume (nVo-V) en dehors du récipient. Ce schéma pourra peut-être t'aider à visualiser la situation et à calculer le travail fourni au gaz par l'air atmosphérique extérieur au système.
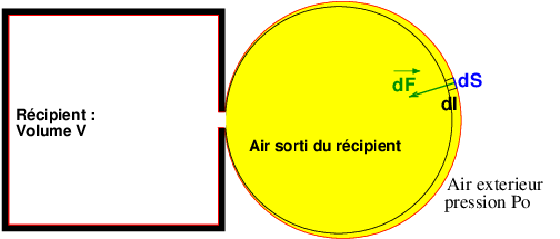
merci beaucoup et je m'excuse du retard de réponses j'avais des évaluations.
J'ai vraiment un problème avec cette matière. J'ai cherché plusieurs documents que ce soit le Tout en un de Physique et le livre de Thermodynamique Tout le cours Edition Nathan, j'ai aussi utilisé un livre du nom de "Plan mondial".Mais j'arrive pas à comprendre cette matière.Je parle ici du contexte des exercices mais les formules je les comprends.
En fait c'était pour savoir si vous auriez une fiche d'exercice corrigés ou un livre en support numérique qui pourrait m'aider concernant la thermodynamique s'il vous plait
Tu as déjà les deux fiches que j'ai publiées sur le forum. Elles contiennent plusieurs exercices corrigés de façon détaillée. N'hésite pas ensuite à poser, si tu le juges utile, des questions précises.
![]() Premier principe de la thermodynamique
Premier principe de la thermodynamique
![]() Deuxième principe de la thermodynamique
Deuxième principe de la thermodynamique


