Inscription / Connexion Nouveau Sujet
schéma lewis
Bonjour,
voici un nouvel exercice. ce ne comprend rien. pas de support leçon.
avez vous un support pour m'aider ? j'ai fait avec mon bon sens!
1) j'ai rempli le tableau que je pense est correct mais je ne comprends pas l'histoire des électrons que l'entourent;
2) ces atomes sont ils stables ?
la proposition 1 me semble plus stable car il y a un nb identique de liaisons.
3) proposition 1 :
N-H :390+
C=N :615+
C=S: 430
=1435
proposition 2
N=C :615+
C-S : 272 +
S-H : 364
=1251
mais pour calculer N triple liaison C, faut il faire calculer C N =890- C =N (615) = 275 ?
5) j'ai ajouté un double tiret sur le schéma joint au niveau de H tout à droite . est ce cela ?
6) formules brutes des molécules suivantes
C4+H9+O2
Merci pour votre aide précieuse
Bonjour,
Question 1 :
Ton tableau : OK
Electrons qui l'entourent : Chaque doublet (liant on non) qui entoure un atome compte 2 électrons
Question 2 : Appliquer la règle de l'octet à chaque atome pour décider de sa stabilité.
Question 3 : Proposition 1 : OK (sauf unité manquante)
Proposition 2 : Erreur d'énoncé. La triple liaison C≡N a une énergie de liaison de 890 kJ/mol
Question 4 : La molécule la plus stable est celle dont la somme des énergies de liaisons est la plus grande.
Question 5 : Cette question porte sur la molécule de droite située en dessous du texte de cette question.
Indice : il y a 5 doublets non liants à ajouter
Question 6 : Le mauvais cadrage de la molécule de gauche ne permet pas de répondre.
Pour celle de droite : C4H9O2 et pas C4+H9+O2
Question 6 :
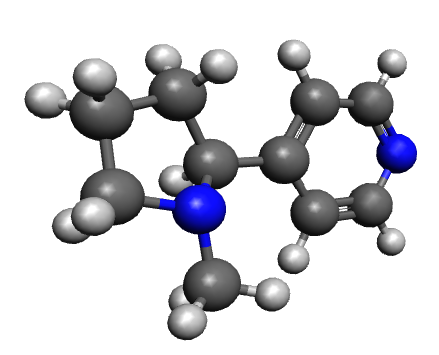
Finalement, j'ai identifié la (très nocive) molécule de gauche.
Tu peux, si tu le juges utile, faire une proposition de réponse.
Que vient faire le Fer (Fe) dans cette étrange réponse ?
Désolé, mais je comprends si peu ce que tu as écrit que je ne sais même pas à laquelle des questions tu réponds.
pour la question 2 les atomes doivent gagner ou perdre des électrons pour se rapprocher des gaz rares de 1 à 3 électrons règle de l'octet; mais pour C il doit gagner aussi 4 électrons et devenir un ion C4- est ce possible ?
avec mes remerciements
pour la question 6, la molécule de gauche ;
en bleu sont représentés les 2 atomes de N.
en Blanc sont représentés les 18 atomes d'H
en gris sont représentés les 10 atomes de Fe
est ce que je me suis trompé dans les correspondances avec les coloris ?
Oui !
Tes atomes de Fer sont des atomes de Carbone.
Ci joint une image de la molécule concernée orientée différemment que celle de l'énoncé.
Question 2 :
Tu n'as pas bien compris la question qu'on te pose.
Une fois les liaisons établies, un atome est stable s'il obéit à la règle de l'octet ou du duet (pour H)
C'est la cas ici : Tous les atomes des deux molécules obéissent à cette règle car ils sont tous entourés par 8 électrons (pour C, S, N) ou 2 électrons (pour H)
Cela se voit nettement si on a rempli correctement la dernière ligne du tableau " Electrons qui l'entourent "


