Inscription / Connexion Nouveau Sujet
Représentations molécules
Bonsoir,
je sais ce qu'est la formule brute, développée et semi-développée d'une molécule mais je ne sais pas comment les représenter... tout le monde dans ma classe y arrive (même les personnes qui ont 2, 3 et 4 de moyenne) sauf moi alors que je suis une élève "normale" dans la matière (13 de moyenne)... Si admettons on a une formule brute, comment représenter sa formule développée ? Savoir si on va vers le haut, si on met telle ou telle molécule au milieu, à côté de l'atome A ou B, bref, l'incompréhension totale... Merci à ceux qui prendront le temps de m'aider !
Salut !
En gros, une formule brute peux avoir différente formule développé et semi développé !
C'est ce qu'on appelle l'isomérie.
En gros, si tu as une formule développé, et bien tu peux essayer de placer les atome comme tu le souhaite, a condition de trouver la bonne combinaison qui permet a chaque atomes de former le nombres exacte de liaison;
Cela viens donc avec l'entrainement !
Voila l'exemple de la molécule C4H10O, qui possède différente formule (semi)développé !
Mon conseil est de toujours placé tout les atomes de carbone afin de former le "squelette" et de complété avec les hydroène etc ( car le carbone forme 4 liaison, contre 1 pour l'hydrogène et 2 pour l'oxygène !)
---------
Si tu as d'autres questions, n'hésite pas !
Merci pour ton aide !
Tu me conseillerais d'abord d'apprendre par cur le nombre de liaisons que chaque atome peut faire ?
Ce n'est pas un conseil, tu en est même obligé !!
Enfin, pas tous, il y en a trop..mais seulement les principales : Carbone 4liaisons, Hydrogène 1 liaison, oxygène 2 liaisons, azote (Na)3 liaisons, chlore (Cl) 1 liaison.
La plupart des molécules que tu travaillera serons formé de ces atomes, il est cependant possible d'en rencontrer d'autres, mais dans ce cas soit on te dira combien l'atome en question forme de liaison, soit on te donnera son numéro atomique Z et tu pourras en déduire le nbrs de liaison ( ex: Z=9 donc tu as K2L7, ainsi l'atome ayant pour numéro atomique 9 forme 1 liaison pour respectrer la regle de l'octet)

Par exemple, pour cette molécule, la formule brute est C3H8O ?
(j'ai une question, au par ailleurs : quel est l'ordre des lettres pour écrire une formule brute ? faut-il toujours mettre les atomes de carbone en premier ?)
Et quelle est la formule semi-développée de cette molécule ?
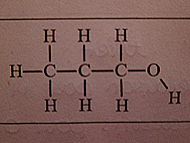
En generale on adopte cette ordre la, mais j'ai envis de dire,que tu mette C3H8O ou H8OC3 ce n'est pas plus mal 
Pour cette formule brute, tu peux essayer ces squelettes :
C---C---C---O
C---O---C---C
O
|
C---C---C
Et puis completer avec les hydrogene afin de former 4liaisons chez C, 1 chez H et 2 chez O.
Pour la formule semi developpé que vous me demandé, c'est :
CH3---CH2---CH2---OH.
Voili voilou 
Et est-ce que ça aurait pu être :
CH5 ━ CH ━ CH ━ OH
ou encore
CH2 ━ CH2 ━ OH2 ━ CH2
les formules semi-développées ?
Bah non !
Dans ta premiere formule semi développées le premier carbone forme 6 liaisons ! ( 5 avec les hydrogènes et 1 avec le carbone suivant..),
et les carbone 2 et 3 forme que 3 liaisons !
Dans ta 2eme formule, le premier carbone forme seulement 3 liaisons, tout comme le dernier et l'oxygne forme 4 liaisons..
Tant que le bon nombres de liaisons n'est pas respecté, c'est faux !
D'accord... C'est un vrai casse-tête, les molécules ! Mais si on le prend comme un jeu, ça peut aller ! 
Prenons pour exemple une autre molécule, plus dur cette fois-ci...
Ai-je bon ?
Formule brute : C6H8O6
Par contre formule développée j'y arrive pas... J'y arriverai jamais ! 
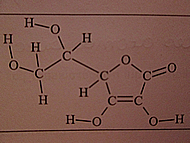
C'est compliqué au début, mais entraine toi a va devenir naturelle..
En effet, elle est compliqué 
Tu l'a faite toi même ? parce que c'est parfait ^^
Si tu réussis a faire la formule semi développé, alors tu réussis la formule développé, il te faut juste mettre toutes les liaisons !
Non, faut pas exagérer, c'est dans mon classeur de physique chimie... 
Je n'y arrive vraiment pas, par quel atome commencer... Peux-tu m'aider ? 
Je suis vraiment déterminé à comprendre parce que je veux une bonne note au contrôle ! Puis en plus, c'est assez intéressant les médicaments etc. ! :p
Je suis d'accord avec toi, c'est pas très compliqué donc c'est l'occasion d'amasser un max de points !
Cette molécule est un peux complexe donc je te conseille de commencer par des molécules plus simple, et de te corriger ( tu tape la formule brute sur Google image et tu trouve les formule semi développé).
Je suis en première et c'est comme ca que l'année derniere j'ai fait pour pouvoir comprendre totalement, l'entrainement c'est la clé !
Prend donc par exemple c5h12o, tente de trouver toutes les formules semi développées !
Si tu veux te corrigé, tape C5H12O sur Google image et la première image te fournis toutes les combinaisons possibles !!
Une fois que tu en aura fait plusieurs, on pourra passer a ta molécule (C6H8O6), car quand il y as majoritairement des carbone et hydrogène, c'est pas très compliqué, mais quand les autres atomes sont nombreux, il faut un peux plus réfléchir.
De toute facon, il n'y a pas de technique universelle, il faut juste avoir l'il et essayer.
Je pense que tu as raison, il va falloir que je m'entraîne pendant les vacances. 
j'essaierai ta molécule tout à l'heure, mais as-tu idée de ce que ce modèle moléculaire pourrait être ? j'ai pensé à C4H5O4 mais je suis pas sûr du tout...

Euh non je ne vois pas vraiment..
Je vois en effet C4 et H5 mais il y a un problème avec les atomes "noirs" car certains forme 1 liaison, d'autre 2 et d'autre 3
D'où as tu pris cette molécule ?
Toutes les molécules que je poste sur ce forum viennent de mon classeur de physique-chimie. Notre prof nous a donné une feuille avec 10 molécules et 4 colonnes (formule brute, formule développée, formule semi-développée, modèle moléculaire) et, pour chaque molécule, il y a une colonne de remplie et c'est à nous de remplir les trois autres.
Après réflexion, je pense que ce sont des couleurs qui sont mal passées à l'imprimante, et que celui qui fait une seule liaison est du chlore, celui qui en fait deux, de l'oxygène, et ceux qui en font trois, de l'azote...
On peux en effet deviner que cela correspond a C4H5N2OCl, mais en DS, tu aura quelque chose de plus precis !



