Inscription / Connexion Nouveau Sujet
Représentation de Lewis des molécules
Salut à tous
En faite je voudrais juste savoir une petite chose^^
Ces 2 représentations de la molécule C2H4 sont tous justes ou bien il y en a un de faux?
Merci 
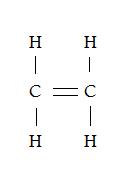
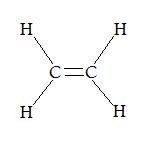
Salut,
Les deux représentations sont justes, la représentation de lewis ne tien pas compte de la géométrie de la molécule. Tu trouveras plus souvent la deuxième représentation dans tes livres et exercices car elle est plus...esthétique 
ok merci beaucoup 
En fait j'ai un autre problème, c'est la isomérie. Je n'arrive pas à trouver toutes les combinaisons possibles.
Peut tu me donner un exemple et m'expliquer s'il te plait?
merci 
C'est simple l'isomérie 
Il faut que pour une formule brute donnée tu arrive à trouver tout les isomères c'est à dire toutes les formules développées qui peuvent représenter la molécule.
Prenons un exemple CH4H10 est une formule brute, comment le représenter en développé ?
CH3-CH2-CH2-CH3 ou CH3-CH-CH3
|
CH3
Voici deux isomères de CH4H10 c'est à dire que le butane et le méthylpropane ont tout les deux la même formule brute.

TiT126,
excuse-moi mais tu as inversé formule developpée et semi-developpée.
Ce que to donne çi-dessus sont des formules semi-developpées, les formules developpées étant pareille que la représentation de Lewis sans noté les doublets non-liants.
Exemple avec l'éthanol et le méthoxyméthane a propos de l'isomérie :
Formule brute :
Formule developpée :
1)Ethanol :
H H
| |
H-C-C-O-H
| |
H H
2) Méthoxyméthane
H H
| |
H-C-O-C-H
| |
H H
Formules semi-developpées :
1) Ethanol :
2)Méthoxyméthane
Voiloù ! Applique ceci a ton exercice,
Bonne chance, Gros-beta.
Effectivement, j'ai pas fait la différence entre semi développée et développée, merci pour ta rectification.




