Inscription / Connexion Nouveau Sujet
representation de lewis.
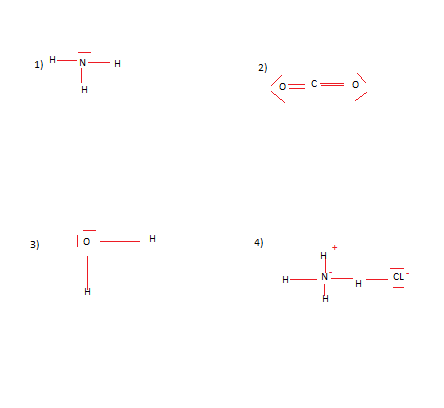
Bonjour à tout le monde , j'ai fait un exercice sur la representation de lewis , et j'aimerais savoir si mes reponses sont exactes . Jai un petit doute sur le numero 4). Merci d'avance pour vos explications.
salut  !
!
Mais déjà 1) 2) et 3) sont cohérentes... Par contre tu as un H qui fait deux liaisons pour la 4... Et ça c'est pas terrible 
Bonjour à tout le monde , et merci pour les gens qui m'ont répondu .
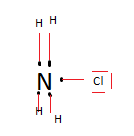
En fait pour la representation 4) , je voulais representer le chlorure d'ammonium. Merci aux personnes qui pourront m'aider et m'expliquercomment faire quand il y a des ions dans les representations , merci.
je pense tu sais que le N peut avoir 3 doublets liant et un doublet non liant dans sa forme seulement d'atome
le cl peut avoir 3 doublets non liant et un liant
et un H peut avoir seulement une liaison
comme tu veut représenter le NH4Cl
tu sait que N possède 5 électrons de valences sur sa couche la plus externe
que H possède qu'1 électron mais comme il est présent 4 fois donc 4*1 électron
que cl possède 7 électrons de valence
donc tu fait (4*1+7+5)/2=16/2=8 c'est le nombre de doublet que tu doit avoir
et en plus tu doit respecter la règle de l'octet
donc le H ne peut être relié au cl et N en même temps
donc je pense que N relier au 4 H et au Cl par une simple liaison et en plus le Cl comporte 3 doublets non liant
je ne pense pas qu'il y ai de charge a mettre
mais dans sa forme hydrolyse totale je crois que cela se nomme comme cela pour le fait qu'il n'y ai que des ions ici NH4+ et Cl-
je te rappelle que quand tu a des charge par exemple dans H3O+
3*H = 3 électrons de valence
O=6 e- de valence
donc ((6+3)-1)/2=4 liaison soit non liant ou liant on a -1 car une charge + si -2 2charge + etc
donc O relié aux 3 H par simple liaison et O porte un doublet non liant et une charge + car perd un de ces électrons il lui en faut 6 pour faire sa couche de valence mais comme quand tu compte il a 3 électrons qui sont en jeu avec les H et un doublet non liant et donc pour faire 6 il faut mettre charge + sur le O
donc 3 liaison simple entre H et O + 1 doublet non liant sur O = 4 liaisons
autre exemple ICl4-
I=7e de valence
4*Cl= 4*(7 électrons de valence) = 28
donc ((7+4*7)+1)/2=18 +1 car une charge -
donc chaque Cl est relié par une liaison simple au I et les cl porte chacun 3 doublets non liant et le I porte en plus 2 doublets non liant
donc 3*4 liaisons non liant dans Cl+ 4 doublets liant entre Cl et I + 2 doublets non liant sur I = 18 liaisons
---donc dans chaque molécule tu vérifie le nombre de liaisons qui doit faire pour H3O+ 4 et pour Icl4- 18 liaisons
et vérifier le nb de valence pour chaque atome
rappel ou petit cours
électron de valence: La couche de valence (ou couche périphérique) d'un atome est sa dernière couche électronique partiellement ou totalement remplie.
exemple
Groupe nombre d'électrons
de valence
groupe 1 (I) (métaux alcalins) 1
groupe 2 (II) (métaux alcalino-terreux) 2
groupe 13 (III) (Bore) 3
groupe 14 (IV) (Carbone) 4
groupe 15 (V) (Azotes) 5
groupe 16 (VI) (L'oxygène) 6
groupe 17 (VII) (Halogènes) 7
groupe 18 (VIII ou 0) (Gaz rares ou inertes) 8 (sauf He : 2)
donc j'espère que cela t'aura aidé
en plus j'ai oublié de dire que dans Icl4- par de charge à mettre car il gagne un électron en plus pour que I respecte la règle de l'octet I donc 2 liaison non liant donc 4 électrons + 4 électrons provenant des doublets liant
donc une charge + signifie perd un électron et une charge - signifie gagne un électron
Bonjour à tous , d'apres les conseils de mrcm (je le remercie par la meme occasion) , j'ai refait mon schema en esperant que cette fois si , il est correct .