Inscription / Connexion Nouveau Sujet
Notions concernant la thermodynamique
Bonjour à toutes et à tous,
Je souhaite aider mon fils qui est en 2nde sur un devoir de physique pour l'aider à comprendre les notions de thermodynamique. Mais je pêche sur quelques questions.
Voici l'énoncé de l'exercice 1 :
Nous plaçons 200mL d'eau à l'intérieur d'un calorimètre.
On relève la température à l'équilibre thermique :  i
i
On ajoute un glaçon sorti du congélateur à la température  g et de masse mg dans le calorimètre.
g et de masse mg dans le calorimètre.
Après équilibre thermique, on relève la température finale de l'eau dans le calorimètre  f.
f.
Données :
Capacité thermique eau : 4180 J/kg/C°
Capacité thermique glace : 2060 J/kg/C°
Masse volumique eau : 1 g/mL
Chaleur de fusion de l'eau : 333 kJ/kg
Température initiale : 22°C
Température glace : -5°C
Température finale : 11°C
1) Faire un diagramme représentant les échanges thermiques
Je ne sais pas à quoi doit correspondre ce diagramme.
2) Déterminer la quantité de chaleur échangée par l'eau contenue initialement dans le calorimètre entre  i et
i et  f
f
D'après la formule : Q = m * C * ( f -
f -  i)
i)
Q = 0.2 * 4180 * (11-22) = -9196 J
3) Déterminer expression littérale de la quantité de chaleur échangée par la glace entre  g et 0°C
g et 0°C
Q = mg * Cg * (0°C -  g)
g)
4) Déterminer expression littérale de la quantité de chaleur échangée par la glace pour le changement d'état
Je ne sais pas ce qu'il faut indiquer
5) Déterminer expression littérale de la quantité de chaleur échangée par l'eau liquide du glaçon fondu pour atteindre  f
f
Je ne sais pas ce qu'il faut indiquer
6) En justifiant, déduire de ce qui précède l'expression de la masse du glaçon mg
Je ne sais pas ce qu'il faut indiquer
7) Déterminer la valeur numérique de la masse du glaçon mg
Je ne sais pas ce qu'il faut indiquer
Bonsoir
Pour 1 il s'agit sans doute de schématiser le fait que l'eau se refroidit alors que le glaçon évolue en 3 étapes :
Réchauffement de la glace jusqu'à 0°C
Fusion de la glace
Échauffement de la glace fondue (eau ) jusqu'à la température finale.
Cela aide pour la suite.
J'aurais tendance à dire pour le schéma quelque chose comme image en pièce joiinte ?
4) Le changement d'état se fait quand la glace commence à fondre. Donc on doit faire intervenir la chaleur de fusion ?
Q = m * Lfusion ?
J'ai trouvé cela dans un cours mais comment la déterminer à partir des questions précédentes ?
Je ne vois pas pour le reste 
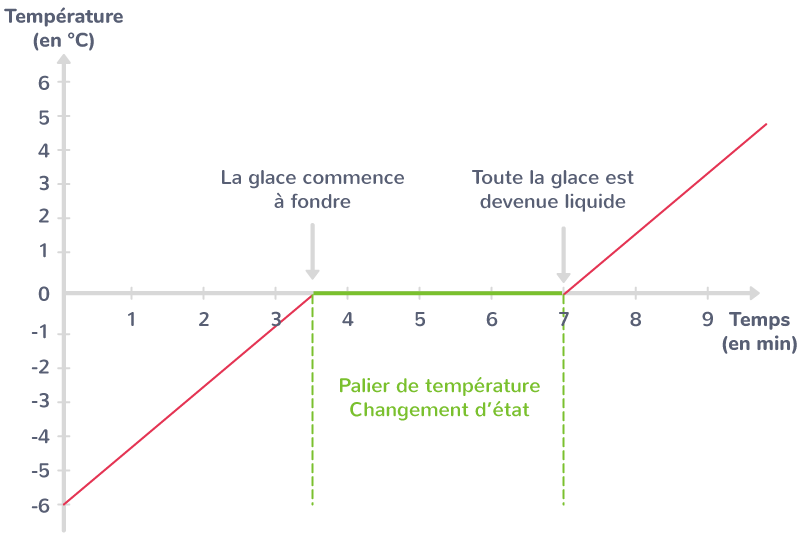
Ok pour la fusion de la glace. La chaleur massique latente de fusion Lfusion est appelé improprement dans l'énoncé chaleur de fusion de l'eau, ce qui n'a pas de sens.
Pour la suite, il faut considérer que l'échange de chaleur se fait uniquement entre l'eau initiale et le glaçon qui fond. Cela revient à écrire que la somme des quantités de chaleur est nulle. Cela conduit à une équation dont la seule inconnue est la masse de glace initiale.
Pour moi j'ai donc 3 étapes sur le glaçon :
- Passage du glaçon de -5°C à 0°C
Q = mglace*Cglace(0-(-5))
- Fonte glace à 0 °C
Q = mglace * Lfusion
- Passage de l'eau de 0°C à 11°C
Q = (meau + mglaçon) * Ceau (11-0)
Du coup je vois pas l'équation à 1 inconnue découlant de cela
D'accord avec toi sauf pour la dernière quantité. C'est seulement la masse de glace fondue qui passe de 0 à 11°C.
La masse d'eau initiale passe de 22 à 11 °C.
C'est cette eau qui en se refroidissant échange une quantité de chaleur négative de sorte que la somme de toutes les quantités de chaleur soit nulle.
Donc question 5 :
-Qeau = Qglace
Question 6 :
-Qeau = Qglace
-Qeau = mglace * Cglace (0-Tglace)
-Qeau / Cglace (0-Tglace) = mglace
Question 7 :
Je calcule avec Tglace = -5°C ?
Tu as bien
-Qeau=Qglace
à condition d'appeler Qglace la somme des trois quantités détaillées précédemment.
D'accord !
-Qeau = Qglace
-Qeau = Q-5°C à 0°C + Qfusion + Q0°C à 11°C
-Qeau = (m * Cg (0-(-5)) + (m * Lfusion) + (m * Cg (11-0))
On factorise par m à droite et on a :
-Qeau / (16 * Cg + Lfusion) = mg
Bonjour,
J'arrive après la bataille, pour signaler une erreur dans ton dernier post (21-02-20 à 22:16)
Cette erreur concerne la quantité de chaleur reçue par l'eau de fusion du glaçon que tu notes Q0°C à 11°C
Cette quantité de chaleur n'est pas égale à m * Cg (11-0) puisque ce n'est pas de la glace mais de l'eau liquide qui passe de 0°C à 11°C
En fait :
Q0°C à 11°C = mg * C* (11-0)
expression dans laquelle C désigne la capacité thermique massique de l'eau liquide C = 4180 J/kg/°C et mg la masse du glaçon (égale à la masse de l'eau de fusion)


