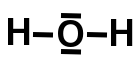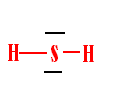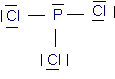Inscription / Connexion Nouveau Sujet
Molécules à liaisons simples
Bonjour, j'ai un problème à un exercice, je bloque dessus depuis un certain temps... Pouviez vous m'aider ? Merci d'avance.
Donner les formules de Lewis des molécules de formules brutes suivantes :
-Dihydrogène h2, gaz inflammable plus léger que l'air.
-Dichlore CL2, gaz de couleur verte.
-eau h2o
- sulfure d'hydrogène h2s, gaz à odeur nauséabonde.
-trichlorure de phosphore PCL3
-Ethanol C2H6O, alcool des boissons alcoolisées pour lequel l'atome d'oxygène est porteur d'un seul atome d'hydrogène.
-trichlorosilane SiHcl3, intérmédiaire dans l'laboration du silicium des puces electroniques. Pour ce composé, l'atome de silicium est central.
Données : H : Z = 1 ; C : Z = 6 ; O : Z = 8 ; Si : Z = 14 ; P : Z = 15 ; S : Z = 16 ; Cl : Z = 17
Je comprends pas le texte fout quoi ici alors qu'on demande formule de Lewis... Et les données  :?
:?
Bonjour
Je pense qu'on te demande ici de construire un tableau qui regroupe, les couches électroniques des atomes, les électrons de valence, les doublets non liants et les doublets liants !
Bonjour, merci d'avoir répondu.
J'aurais plutôt penser qu'il fallait que je représente les formules brutes en développée non ?
Ex : Dihydrogène h2 => H-H ?
Bonjour.
On vous donne les numéros atomiques, c'est pour déterminer le nombre d'électrons composant le nuage et déterminer sa structure électronique KLM.
Ensuite, c'est une application des règles du duet et de l'octet.
Voici les deux premiers en guise d'exemple :
Exemple 1
H (Z = 1) possède donc 1 électron (par neutralité électrique de l'atome).
La structure de son cortège est donc K1.
Si vous voulez l'associer à un autre H (K1), vous devez mettre en commun leur électrons pour former une liaison covalente. (règle du duet)
Ainsi vous avez la structure suivante : H - H qui est la forme de Lewis pour H2.
Exemple 2
Cl (Z = 17) possède 17 électrons autour du noyau.
Sa structure est K2 L8 M7.
Cet atome de chlore souhaite obtenir sa dernière couche saturée avec 8 électrons (règle de l'octet, structure du gaz noble le plus proche).
Donc il a besoin d'un électron que va lui prêter un autre atome de Chlore.
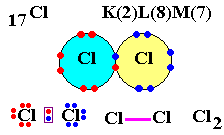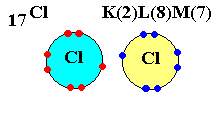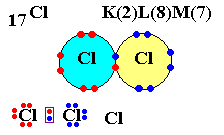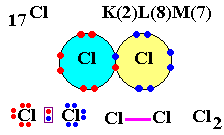
Après mise en commun, vous vous retrouvez avec les atomes de chlore liés ainsi : Cl - Cl
Par contre, ce n'est pas le schéma de Lewis.
Mais que font les autres électrons restants ?
Ils s'associent par 2 pour former ce qu'on appelle un doublet non liant et vous obtenez ceci :