Inscription / Connexion Nouveau Sujet
Mole, volume et tableau d'avancement
Les 2 questions sont independantes.
On fait reagir de l'aluminium solide avec de l'eau; on obtient un degagement de dihydrogene et un oxyde d'aluminium Al2O3.
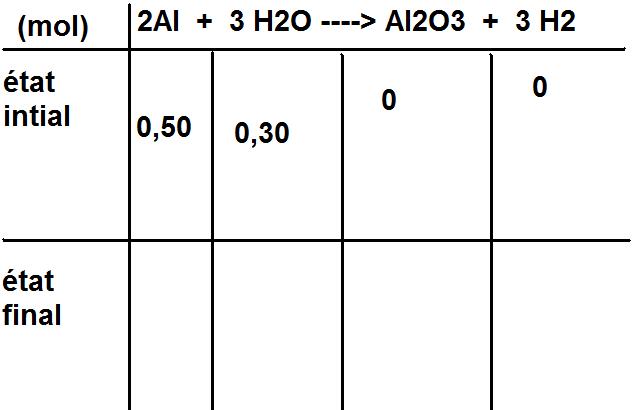
1) On utilise 0.50 mole d'aluminium et 0.30 mole d'eau.
a)Faire tableau d'avancement.
b)Determiner avancement maxi et le reactif limitant.
c)En deduire le volume de dihydrogene et masse d'oxyde d'aluminium obtenus.
2) On veut obtenir 17.6 L de dihydrogene.
a)Determiner l'avancement maxi.
b)Calculer les quantités de matiere, dans les proportions stoechiometriques, d'aluminium et d'eau utilisées, et la quantité de matiere d'oxyde d'aluminium.
J'ai fait le 1) a, b et la masse du c). mais le volume me pose probleme comme la 2).
Merci en avance pour votre aide 
Medina
Bonjour! Merci de me repondre aussi vite 
2Al + 3 H2O ----> Al2O3 + 3 H2
C'est ca?  Pourtant je ne vois pas comment je peux l'utiliser pour le 2 b)...
Pourtant je ne vois pas comment je peux l'utiliser pour le 2 b)...
Oui c'est juste.
Maintenant dresse un tableau d'avancement avec les deux étapes : état initial, état final
Merci Romane 
Pourtant les 2 questions sont independantes! Et celles qui me posent probleme sont 1 c et 2(a et b) car pour le 2 je dois les calculer....je ne comprend pas!