Inscription / Connexion Nouveau Sujet
masse volumique et concentration en masse
Bonjour,
Je cherche l'équation littérale entre la masse volumique d'une solution ( ) et la concentration en masse d'un soluté présent dans la solution (Cm).
) et la concentration en masse d'un soluté présent dans la solution (Cm).
 = m (solution) / V (solution)
= m (solution) / V (solution)
 = [m (soluté) + m(solvant)] / V (solution)
= [m (soluté) + m(solvant)] / V (solution)
Donc  = Cm + m(solvant)/ V (solution)
= Cm + m(solvant)/ V (solution)
Ainsi, pour une solution ayant une concentration en masse "faible", je peux assimiler le volume de solution au volume de solvant est ainsi obtenir  = Cm +
= Cm +  solvant
solvant
Si je trace  en fonction de Cm, le coefficient directeur devrait être 1. Or, expérimentalement, j'obtiens un coefficient directeur d'environ 0,35.
en fonction de Cm, le coefficient directeur devrait être 1. Or, expérimentalement, j'obtiens un coefficient directeur d'environ 0,35.
D'où vient cet écart ? Est-ce une erreur de mon raisonnement ?
C'est à dire, en effectuant un dosage par étalonnage via la masse volumique, j'aimerai bien modéliser la courbe obtenue (  = f(Cm)) par une équation mais je ne comprends pas pourquoi il y a un facteur différent que 1 devant Cm (via la fonction affine
= f(Cm)) par une équation mais je ne comprends pas pourquoi il y a un facteur différent que 1 devant Cm (via la fonction affine  =
=  solvant + Cm )
solvant + Cm )
Ou c'est juste que les valeurs expérimentales sont légérements éloignées mais je devrais avoir 1 comme coefficent directeur ?
Bonsoir
Il y a des choses correcte dans ton raisonnement :
* la dissolution conserve la masse ;
* la limite quand Cm tend vers zéro de la masse volumique est bien celle du solvant.
De plus : ta formule :
 = Cm + m(solvant)/ V (solution)
= Cm + m(solvant)/ V (solution)
est correcte mais il ne faut pas en déduire pour autant que la courbe représentant  en fonction de Cm est une droite de coefficient directeur 1 car m(solvant)/ V (solution) diffère nettement de
en fonction de Cm est une droite de coefficient directeur 1 car m(solvant)/ V (solution) diffère nettement de  solvant et varie en fonction de Cm.
solvant et varie en fonction de Cm.
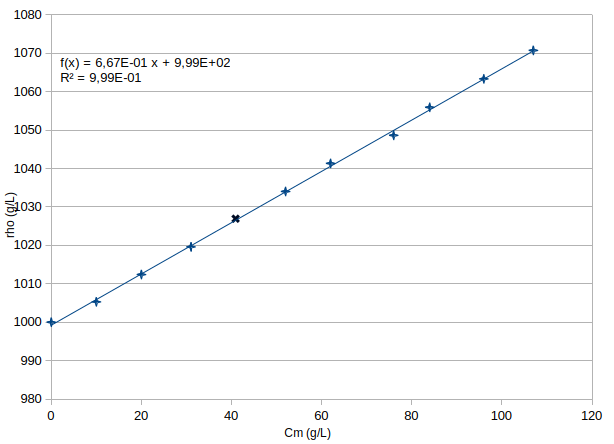
Par exemple, pour obtenir un litre d'eau salée de concentration massique en NaCl égale à Cm=10g/L, il faut dissoudre 10g de NaCl dans 995mL d'eau. La masse volumique étant alors égale à 1005g/L . Il y a bien conservation de la masse. Le résultat est relativement éloigné de celui que l'on obtiendrait avec ta formule : 1010g/L : la variation de masse volumique par rapport à celle de l'eau pure est deux fois plus faible que celle que l'on obtiendrait avec ta formule. Cela s'explique par le fait que la dissolution ne conserve pas du tout les volumes.
Voici la courbe obtenue pour une solution de NaCl. Effectivement, le coefficient directeur de la droite moyenne est nettement inférieur à 1 et dépend de la nature du solvant et de la nature du soluté.
Bonjour,
D'accord, c'est très clair.
Je ne comprends pas bien la phrase "la dissolution ne conserve pas du tout les volumes".
Pourtant tu as bien fait Vsolution = Vsolvant + Vsoluté
Veau salée = Veau + Vsel
Et donc pour une concentration en masse de sel de 10 g/L pour une solution d'1 litre :
Veau = Veau salée - Vsel
Veau = 1000 - msel/ sel = 995 mL.
sel = 995 mL.
Par contre pour un soluté liquide miscible avec le solvant par exemple l'alcool avec de l'eau, on est d'accord que cette relation (Vsolution = Vsolvant + Vsoluté) ne fonctionne plus ?
Ok, donc en considérant V solution = V solvant + V soluté, j'obtiens:
p (solution) = [1 - p(solvant)/p(soluté] * Cm + p (solvant)
Ce qui est cohérent avec le coefficient directeur cette fois-ci
Non : dans le cas général, la dissolution ne conserve pas les volumes. Comme tu le dis, il n'y a pas conservation du volume lors du mélange de deux liquides mais il n'y a pas non plus conservation du volume lors de la dissolution d'un solide dans un liquide. Je prends l'exemple de l'avant dernier point expérimental de la courbe que j'ai tracée. Pour obtenir un litre d'eau salée contenant Cm=107g/L de NaCl, il faut mélanger 107g de NaCl avec 964mL d'eau. La masse volumique du chlorure de sodium solide vaut 2,16g/mL. Ainsi 107g de NaCl pur occupe un volume de 49,5mL. On constate :
49,5+964=1013,5 > 1000
La dissolution entraîne une diminution de volume de 13,5mL, ce qui n'est pas énorme en valeur relative (1,35%) mais pas négligeable quand même
C'est juste expérimental. Les phénomènes de dissolution font intervenir des mécanismes complexes dont les conséquences sont difficiles à quantifier. Il faut donc s'en remettre à l'expérience.


