Inscription / Connexion Nouveau Sujet
masse molaire
Bonjour,pourriez vous m'aider pour cette exercice merci
L'exercice est le suivant:
En utilisant la classification periodique des elements repondez aux questions
a)quelles sont les masses molaires du mercure (Hg) et de l'or (Au)
b)quelle est la masse molaire M de l'acide ascorbique de formule brute C6H8O6
Il est clairement écrit dans ton énoncé ce que tu dois faire ... soit utiliser le tableau de classification périodique des éléments.
Voila une copie d'une partie de ce tableau :
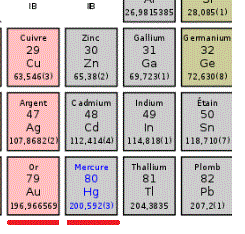
Pour répondre à la question a :
On cherche le mercure (symbole Hg) dans ce tableau et on y lit la masse molaire :
Par exemple pour le Hg : M = 200,592 g/mol
Et pour l'or (symbole Au) ... lis par toi-même dans le tableau.
-----
Pour la question b :
Tu dois rechercher dans la tableau de classification périodique des éléments les masses molaires du carbone (symbole C), de l'hydrogène (symbole H) et de l'oxygène (symbole )
Quand tu les auras trouvés, la masse molaire de C6H8O6 se calcule ainsi:
M = 6 * Masse molaire du carbone + 8 * Masse molaire de l'hydrogène + 6 * masse molaire de l'oxygène
... fais-le.
Sauf distraction. 
bonjour, pouvez vous me dire si cela est correct merci
a)Hg:M 200,6g/mol
Au:M 197,0
b)M (C6H8O6)=6×M(C)+
8×M (H)+6×M (O)
=6×12.0+8×1.00+6×16.0
=176g/mol
Il manque l'unité pour l'AU dans la question a.
Pour le reste, le principe est correct mais j'ignore si ton prof attend ou non que tu utilises les masses molaires données dans le tableau avec toutes leurs décimales.

Non je pense pas que c'est necessaire en cour nous avons fait comme cela.
Et j'ai une autre question a vous poser:
Calculer le nombre de molécule d'eau H2O presentes dans 1Litre d'eau (=1kg)
Aide: Il y a 6.02×10^23 molecules d'eau dans 1 mole d'eau
merci d'avance
1 sujet par topic !!!
"Calculer le nombre de molécules d'eau H2O presentes dans 1Litre d'eau "
M(H2O) = 2*1 + 1 * 16 = 18 g/mol
Quantité de matière dans 1 kg (1000 g) de H2O : n = 1000/18 = 55,56 mol
Nombre de molécules d'eau H2O présentes dans 1 litre d'eau : N = n * A = 55,56 * 6,02.10^23 = 3,34.10^25
-----
Recopier sans comprendre est inutile.
Sauf distraction. 


