Inscription / Connexion Nouveau Sujet
Les molécules: des entités stables
Bonsoir, j'ai un DM à faire pour la rentrée j' ai déjà fait les questions 1,2 et 4 mais je bloque pour la 3, j'aurais besoin d'aide s'il vous plait et pouvez -vous me corriger mes réponses précédentes. Merci d'avance.
** images supprimées => relis les règles du forum, il faut recopier le texte de ton énoncé car il ne dépasse pas un A4 (seuls les schémas et les tableaux cadrés peuvent être insérés). Il en va de même pour tes pistes **
Rebonsoir voici les questions a auxquels je dois répondre :
1. [APP] A l'aide du document C, dénombrer les électrons de valence des atomes de chaque gaz noble.
Hélium: 2 électrons de valence
Néon: 8 électrons de valence
Argon: 8 électrons de valence
2. [ANA] Déterminer, pour chacune des molécules du document B, le nombre d'électrons de valence entourant chaque
atome.
dioxyde de carbone: 2 oxygènes= 4 électrons de valence
Méthane: 4 hydrogènes= 4 électrons de valence
Ammoniac: 3 hydrogènes=3 électrons de valence
Eau: 2 hydrogènes= 2 électrons de valence
Dioxygène: 2 oxygènes= 4 électrons de valences
sulfure d'hydrogène: 2 hydrogènes=2 électrons de valences
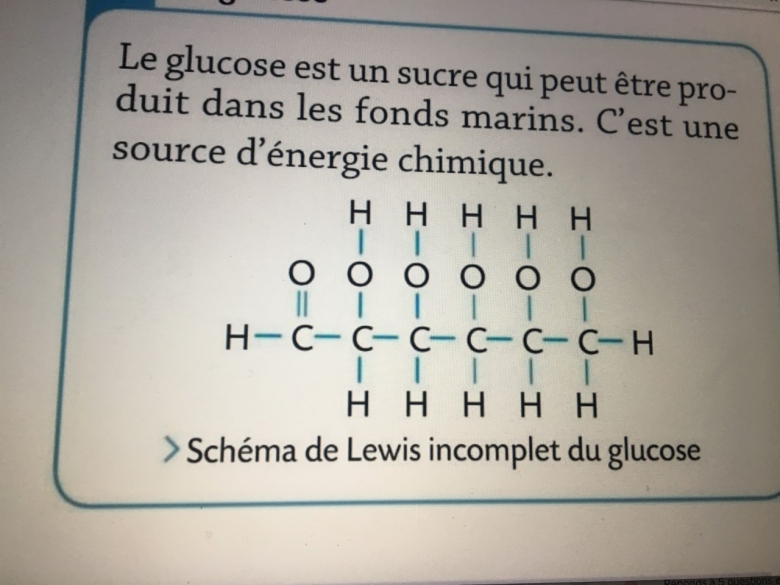
3. [REA] Recopier puis compléter le schéma de Lewis du glucose (document D).
(image ci-joint)
4. [VAL/COM] Proposer un critère de stabilité? pour les atomes formant une molécule et établir une règle afin de répondre à la problématique qui est la suivante :
"Problématique : Comment les atomes peuvent-ils acquérir une stabilité en formant des molécules ? "
- Dans les entités (ions, molécules) qu'ils forment, les atomes ont tendance à adopter la configuration électronique externe du gaz noble le plus proche.
- On peut définir deux règles :
la règle du duet : les atomes dont le numéro atomique est proche de celui de l'hélium Z= 2 ont tendance à adopter sa configuration à deux électrons (1s2) ;
la règle de l'octet : les autres atomes ont tendance à adopter la configuration électronique externe de l'atome dit gaz noble le plus proche avec huit électrons (ns2np6).
***[edit modération] remise en forme dernière question***
Bonjour  !
!
Bonne année 2020 à toi
1) Peux-tu écrire les configurations électroniques stp ? Es-tu sûr de ta réponse pour Ne et Ar ?
Bonne année à toi aussi (en retard)
Les configurations électroniques sont les suivantes:
Hélium: 1s2
Néon: 1s2 2s2 2p6
Argon:1s2 2s2 2p6 3s2 3p6
Et je suis sûr pour ma réponse pour Ne et Ar car tout les gaz nobles ont 8 électrons de valences sauf l'hélium.
Mais j'aurais besoin d'aide pour la question 3 et 4 si possible, merci d'avance
TB ! Mais ça :
Et je suis sûr pour ma réponse pour Ne et Ar car tout les gaz nobles ont 8 électrons de valences sauf l'hélium.
il faut l'écrire !
2) ok mais là aussi il faudra que tu justifies
3) il faut simplement dessiner les doublets non liants. Seuls les atomes d'oxygène sont concernés
4) quand tu formes une molécule, que deviennent tes électrons de valence ? Qu'est-ce-qui se forme ? Que deviennent les électrons de valence qui n'ont pas formé de liaison covalente ?
3) il faut rajouter un trait vertical à coté de chaque côté des atomes d'oxygène pour matérialiser les doublets non liants.
4) quand on forme une molécules les électrons de valence, c'est une association d'atome qui se fait, il y a alors une liaison chimique qui se fait ( liaison covalente ). La liaison covalente se forme lorsque des électrons sont mis en commun entre deux atomes.
La liaison covalente se forme lors de la mise en commun d'électrons.
La liaison ionique se forme lorsque les atomes s'échangent des électrons. Il ne s'agit plus d'un partage d'électrons, mais bel et bien d'un échange.
Et merciii beaucoup pour ta correction !
3) TB, donc en tout 2 doublets non liants pour chaque atome d'oxygène
4) Oui tu peux ajouter ceci : les éléments en jeu dans un solide mettent en commun leurs électrons de valence pour former des liaisons covalentes. Les électrons de valence qui ne participent pas à ces liaisons forment alors des doublets non liants.
Tu as compris l'idée c'est bien , ça fait plaisir de croiser qqn qui propose des pistes de réflexion et qui est réactif aux pistes 
Bonne journée et bonne continuation, n'hésite pas si tu as d'autres questions.


