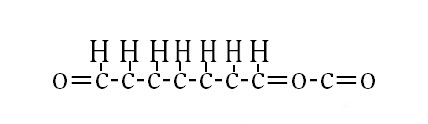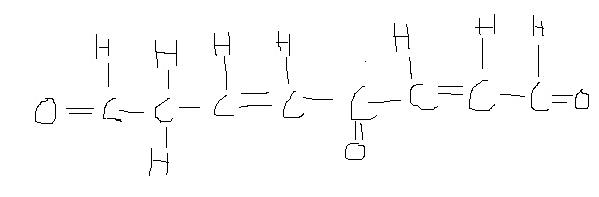Inscription / Connexion Nouveau Sujet
La formule développée et semi developpée
Bonjour,
En cosmétique, dans l'industrie agroalimentaire ou en pharmacie, les parabènes sont utilisés comme conversavteurs grâce a leurs activités antibactérienne et antimyscosique. En raison des doutes qui planent quant à leur innocuité, le nouvel enjeu est de formuler sans parabènes.
On me demande dans un premier tant d'expliquer la phrase " en raison des doutes qui planent à leur innocuité.. " et deuxièmement la formule développé et semi développé du propylparabène et du méthylparabène. Pouvez vous m'aider ?
1. Il y a des doutes concernant leur nuisibilité (ça ce dit ?) .
2. Je n'y arrive pas.
Bonjour ,
Pour la première question , je la trouve très claire .
Pour la seconde question , la formule brute du méthylparabène est :
C8H8O3 , soit 8 carbones , 8 hydrogènes et 3 oxygènes .
En espérant que cela t'aide .
merci de ton aide, mais
1. Comment ça ?
2. Je connais la formule brute, mais je n'arrive pas à la développé c'est ça le problème..
La question 1 est correcte , ça se dit.
Question 2 : quel est le problème ?
Est-ce que c'est parce que tu n'arrives pas à placer tout les hydrogènes ?
J'essaye de faire cette question et je te recontacte .
Pense à passer par la formule développer , ça pourra peut-être également t'aider .
J'ai trouvé !!
Tu mets tout en ligne , les 8 carbones et seulement 2 oxygènes .
Tu mets les oxygènes au extrémités avec des doubles liaisons . Ensuite entre l'avant dernier et le dernier carbone tu mets également une double liaison . Sur le 4ème carbone tu mets un oxygène lié par une double liaison , tu combles ensuite les trous avec des hydrogènes sachant qu'il ne peuvent avoir qu'une seule liaison et que les carbones peuvent en recevoir 4 .
Peux-tu me dire ensuite si ça marche ?
je sais pas si j'ai réellement compris.. j'essaye de faire le propylparabène et tu me corriges, voire si j'ai compris? ça serait sympa