Inscription / Connexion Nouveau Sujet
Exercice physiqe Seconde générale.
Bonsoir à tous les membres 
J'ai un peu de mal avec un exercice qui est tout de même long... Il faut dire que même si j'apprends mes cours, je n'arrive pas à l'appliquer :/
Je dois d'abord donner la formule développée de C4H10O. Je sais déjà qu'une molécule à un centre de symétrie, et que l'atome d'oxygène est lié aux atomes de carbone, il est donc au centre.
(Je m'excuse de la qualité :/)
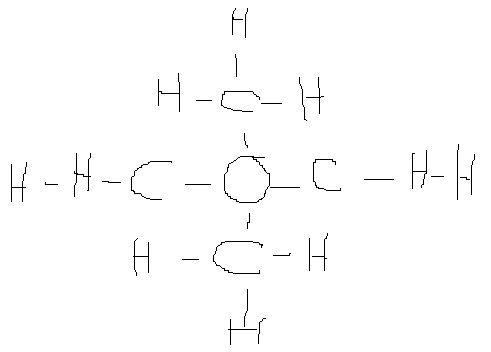
Ensuite je dois donner la forme développée du sulfure de carbonyle. Je sais qu'il faut 1 atome de carbone, d'oxygène et de soufre. Mais je ne sais pas comment faire =/
Je remercie ceux qui m'aideront!
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]()
Bonjour,
Il y a un petit soucis dans ta 1ere formule
Quelle est la structure électronique de chaque atome ?
Combien de liaisons forment-ils chacun ?
Pour le Carbone (k)2(l)4.
Pour l'Hydrogène (k)1
Pour l'Oxygène (k)2(l)6.
J'ai trouvé que l'hydrogène est monovalent et n'a qu'une liaison. L'oxygène est divalent, et il a deux liaisons. Le carbone est tétravalent,, il a 4 liaisons.
Je comprends pas grand chose en physique chimie, c'est pas faute d'essayer pourtant
La physique, comme la chimie d'ailleurs, c'est en faisant pleins d'exos que l'on comprend et que l'on prend des automatismes bien utiles ^^
Te décourage pas, il faut juste de la méthode, face à un exo comme celui là, commence par te demander combien de liaisons forme chaque atome (au passge je connaissais pas les histoires de monovalent, divalent, tétravalent => toujours bon à savoir ^^)
Tu comprends maintenant pourquoi ta 1ere représentation est fausse ?
Ensuite, quelle est la formule brute de sulfure de carbonyle ?
Merci geegee 
Ah d'accord, ben le chlore à une liaison, le phosphore 5 et le silicium 4. Ca c'est pour la déduction du nombre de liaison.
Oui je comprends mieux pour mon schéma, j'avais les éléments mais pas le bon placement en fait. OH est collé comme c'est la fonction alcool.
La formule brute de sulfure d'hydrogène: H2S. 2 en exposant en bas à droite.
En développée: H-S-H et en semi: H2-S.
La formule brute du sulfure de carbonyle: COS. Je dois en donné la formule développée.
Je suis pas d'accord sur le nombre de liaisons du phosphore...quelle est ta structure électronique ?
ok pour le sulfure d'hydrogène
Et d'après toi, pour le formule dvlp du COS ?
Indication : le carbone est au centre
Phosphore: (k)2(l)8(m)5
Et donc ? Combien de liaison il manque pour qu'il respecte la règle de l'octet ?
Tu as dit que l'oxygène forme 2 liaisons...c'est le cas ?
Exact !
L'oxygène forme 2 liaisons, donc il va forcement falloir que tu places au moins une double liaison...
Donc le phosphore forme 3 liaisons, et non 5.
A quoi ressemblerait donc ta formule semi dvlp ?
Oh super 
Sinon, je ne comprends pas si c'est possible de donner deux formules semi-dvp alcool isomères ou éther.
J'ai déjà deux formules brutes à partir de C4H10O:
Le butan-1-ol : CH3-CH2-CH2-CH2-OH
Le diéthyléther(éther): CH3-CH2-O-CH2-CH3
C'est les molécules qui ont la même formule brute, mais avec des enchainements d'atomes différents. C'est un peu comme CHIEN et NICHE en gros, c'est des isomères en français.
C'est ça
Sinon, je ne comprends pas si c'est possible de donner deux formules semi-dvp alcool isomères ou éther.
J'ai déjà deux formules brutes à partir de C4H10O:
Le butan-1-ol : CH3-CH2-CH2-CH2-OH
Le diéthyléther(éther): CH3-CH2-O-CH2-CH3
En fait, c'est pas super clair, il faut que tu formes des isomères à partir de C4H10O ?
Je pense que oui, mon énoncé en lui même n'est pas clair... Dans l'exercice, j'ai la formule C4H10O, dont je dois donner la formule développée, sachant que l'atome d'oxygène est lié à deux atomes de carbone et qu'une molécule possède un centre de symétrie.
-> m
*mon post s'est envoyé et je n'arrive pas à le modifier*
-> ma formule est la même que celle postée par geegee.
Ensuite, je dois donner la formule développée de deux alcools isomères éther (-OH). Je pense que je peux partir de la formule de C4H10O.
Le diéthyléther(éther): CH3-CH2-O-CH2-CH3
donc, c'est la formule qui correspond à cette formule dvlp -> elle possède un centre de symétrie -> O
et comme autre isomère tu as la formule de geegee
Mais la premiere, tu n'as pas de groupement OH
et la deuxieme, pas de centre de symétrie
Je dois pour le a) donner la formule développée de C4H10O, c'est bien :
H H H H
H-C-C-C-C-OH
H H H H
Je ne savais pas si je devais mettre
H H H H
H-C-C-C-C-OH
H H H H
pour la forme développée comme il y a "sachant que l'atome d'oxygène est lié à deux atomes de carbone et qu'il y a un centre de symétrie"


