Inscription / Connexion Nouveau Sujet
Equations à ajuster
Bonjour, j ai un exercice, où je ne comprends pas du tout le principe même si on l'a vu en cours j 'ai fortement du mal, pouvez vous m'aider s'il vous plait? merci
Ajuster les nombres stoechiométriques dans les équations chimiques suivantes:
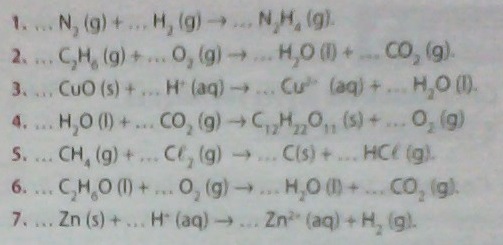
bonjour  !
!
Le but c'est d'avoir le même nombre d'éléments de part et d'autres.
Commence par les H puis occupe-toi des N pour le premier 
On va y aller pas à pas pour que tu y arrives
tu as un problème avec les H.
En tout cas c'est une astuce pour la suite, fais toujours dans cet ordre  Pourquoi équilibrer ? Simplement pour respecter la loi de conversation de la matière. Si avant la réaction (le processus de transformation) tu avais 3 atomes de ceci et 4 atomes de cela, tu dois impérativement les retrouver à la sortie dans ton produit final.
Pourquoi équilibrer ? Simplement pour respecter la loi de conversation de la matière. Si avant la réaction (le processus de transformation) tu avais 3 atomes de ceci et 4 atomes de cela, tu dois impérativement les retrouver à la sortie dans ton produit final.
C2H6 + O2---> CO2 + H2O
2 C à gauche donc :
C2H6 + O2---> 2 CO2 + H2O
6 H à gauche donc 6 H à droite => 3 H2
C2H6 + O2---> 2 CO2 + 3 H2O
On compte les atomes d'oxygène à droite : 4 O + 3 O
C2H6 + 7/2 O2---> 2 CO2 + 3 H2O
Pour éviter les coefficients fractionnaires, on peut multiplier tout par 2
2 C2H6 + 7 O2---> 4 CO2 + 6 H2O
On peut vérifier : 4 C, 12 H, 14 O de chaque côté.


