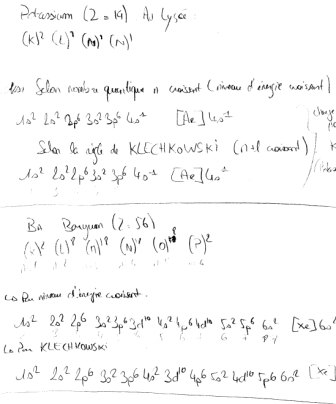Inscription / Connexion Nouveau Sujet
Ecriture fondamental...
Bonsoir, 
Je ne comprend pas l'écriture de la structure électronique des atomes sous cette forme : (Exemple avec le Potassium) K(Z=19) [Ar] 4s^1 Après réflexion, je me suis dit que [Ar] c'était l'Argon et que c'était parceque c'est le gaz noble qu'il respect. Ensuite je me suis dit 4s^1 parceque si on fait (K)^2 (L)^8 (M)^8 (N)^1 alors cela signifi 4eme couche et 1 électrons sur couche externe..Logique jusque là je me suis dit ! Mais pourquoi on met un "s" : 4s^1 ? et des fois je vois "p" ou "d" et "f" .... 
Je prend le lithium en exemple, si on suit ma logique on se dit (K)^2 (L)^1 et donc on écrit 2s pour 2eme couche électronique et ^1 pour 1 électrons sur couche externe donc 1s^2 2s^1maisje suis pas convaicu d'avoir raison, je ne sais pas quel lettre utilisé, pourquoi ? et comment savoir quelle gaz noble un atome repect ? Je penssai que cela fonctionnai par période, mais non, par exemple Mercure Hg sur la période du Radon Rn est pourtant noté [Xe] 4f^14 5d^10 6s^2 
Pouvait vous m'expliquez ?
Un énorme merci d'avance..
Gros-Beta ! 
Euh.. j'ai peut être trop appronfondie je sais mais je suis a fond dessus depuis une semaine les profs me disent "oui, apprend pas ca maintenant"...
Mise a part ma prof de physique qui a essayer de m'expliquer mais elle n'avait pas le temps...
Enfaite je suis tomber sur un site, juste a la base pour chercher le stucture électronique du calcium : Moi j'avais trouvé (K)^2 (L)^8 (M)^8 (N)^1 et mon pote, a juste titre me dit : " Mais pourquoi (M)^8 (N)^1 et pas (M)^9  " Je lui répond parceque sa me parraissait logique selon l'emplacement du Ca dans la Classification (Y'a une autre raison ? si oui j'aimerais la connaitre ?) donc je cherche sur internet et je tombe sur
" Je lui répond parceque sa me parraissait logique selon l'emplacement du Ca dans la Classification (Y'a une autre raison ? si oui j'aimerais la connaitre ?) donc je cherche sur internet et je tombe sur ![]() et
et ![]() , site énormenment trop complexe pour moi..Mais je comprend quelque trucs évidement et justement je me posai des questions sur l'"orbital" parceque j'ai pas tout compris, et j'ai pas envi de laché l'affaire maintenant que je me suis mis ca dans le crâne
, site énormenment trop complexe pour moi..Mais je comprend quelque trucs évidement et justement je me posai des questions sur l'"orbital" parceque j'ai pas tout compris, et j'ai pas envi de laché l'affaire maintenant que je me suis mis ca dans le crâne 
Donc voila  tu connai toute l'histoire, tu peut m'expliquer ?
tu connai toute l'histoire, tu peut m'expliquer ?
Et je pensse avoir compris enfaite le truc des gaz nobles : Enfaite le Mercure Hg, lors de sa transformation en ions prend modèle sur le structure électronique stable en octet du Radon [Rn], mais en atome, il a la meme structure que le Xenon, + les couches notées 4f^14 5d^10 6s^2, donc on note
[Xe] 4f^14 5d^10 6s^2 pour simplifié ?
Tes liens ne marchent pas. En tte honnêteté, je pense que se pencher là-dessus sans maîtriser les représentations de Cram (par exemple), c'est risqué. Tu fais ceci au détriment du reste. Moi je veux bien t'expliquer mais il faut faire intervenir d'autres notions non abordables en seconde...
Si les liens fonctionnent si tu enlève le "l" de html 
Mais ouai j'aimerais quand même que tu m'explique, comme sa au passage j'apprend "d'autres notion" ^^
Bon, avant de me lancer, j'aimerai qd même savoir ce que tu as retenu de tes lectures. J'aimerai surtout savoir si tu as compris ce que sont les niveaux d'énergie quantique
Un niveau d'énergie c'est toutes les valeurs possibles de l'énergies d'une particule, d'un atome, d'un noyau, d'une molécule.
La différence de niveau d'énergie entre des atomes permet de dire leurs niveux d'intéraction avec les photons.
Je ne serait pas définir exactement un photon ; on m'a juste dit : "grain de lumière qui peut donner des basions ou des fermions"
Ensuite, je sais qu'il y a 4 nombres quantique, qui sont n l et m;
-n peut prendre les valeurs de 1,2,3,4,5,6... et sa corespond aux couches que l'on apprend en secande : quand n=1, on parle en seconde de la couche (K).
-l, je sais pas exactement a quoi il correspond, mis a part qu'il sert a définir, avec incertitudes la probabilité des présances d'un électrons dans un atome...Il peut posséder un valeur nul, et toujours inférieur a n-1.
-m, j'y comprend rien.. je sais juste qu'il est compris entre -1 et 1
-s "spin" qui vient de to spin (Tourner sur soi-même) : il peut prendre les valeurs de +1/2 et -1/2 (pourquoi ?) et je n'en sais pas plus..
J'ai également trouvé sur Wikipédia, un diagramme des niveaux d'énergies, mais je sais pas l'expliquer :
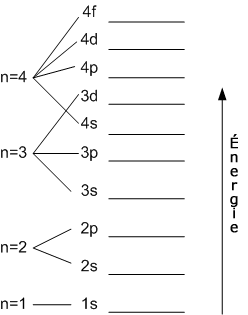
On va procéder par étapes pour combler un peu les lacunes
1) Quelles particules élémentaires connais-tu?
2) Ensuite, super important, est-ce que tu maîtrises la règle du duet et de l'octet et le remplissage des couches électroniques niveau seconde?
3) Qd je serais sûre pour les deux premiers points, je t'expliquerai briévement les niveaux d'énergie quantique. Le plus compliqué étant le spin.
Bonsoir, 
1) Neutron ; Proton ; électons et j'ai déjà entendu parler de Quarks ; fermions et besons (spin  1/2)
1/2)
2)Ouai je maitrise
3) Le spin c'est la rotation non ? Pour les électrons, on parle de spin semi-entiers, c'est tout ce que je sais.
Alors vivement tes explications 
Mais regarde, a force de recherche sur internet, et d'application, j'arrive maintenant a faire ce que je souhaitai a la base : écrire les sous-couches. J'ai compris grâce au principe d'exclusion de Wolfgang Pauli, il est trop fort ce mec 
Exemple (pour montrer que j'ai compris, j'espère):
Baryum Ba (Z=56) En seconde : (K)^2 (L)^8 (M)^18 (N)^18 (O)^8 (P)^2
Pour noter les sous-couches, et les orbitales ont doit avant tout savoir combien chaque sous couches peut contenir d'électrons, pour cela, utilisons le principe d'exclusion de Pauli (2 fermions ne peuvent pas avoir le même nombre quantiques dans un même système d'electron)
Donc si n=1 (nombre quantique principale) (= couche elec. K en seconde)
l=0 (puisque l=0..n-1) ; m=0 (puisque m=-l ou l) ; s=1/2 ou -1/2, donc 2 possibilité pour n=1 donc 1s^2 (on met un s car l=0, le s signifie ici "sharp")
(Je fais ca avec toute les couches) 
[...]
Donc maintenant établissons la structure électronique de l'atome Ba :
Par niveau d'énergie croissant :
1s^2 2s^2 2p^6 3s^2 3p^6 3d^10 4s^2 4p^6 4d^10 5s^2 5p^6 6s^2 soit [Xe] 6s^2
Par n+l croissant (Règle de KLECHKOWSKI)
1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2 soit [Xe] 6s^2
 ??
??
A quoi sa sert de rangé pas niveux d'énergie croissant, ou par n+l croissant ?
A partir de cette structure, comment établit-on la probabilité de situer un atome dans l'espace ? (Equation de Schrödinger ?)
C'est quoi le principe de HUNG ?? (j'ai lu, j'ai pas compris)
Faut vraiment que tu m'explique spin !
T'en as pas marre que je te pose des questions ? 

En tout cas, merci ! 
Gros-beta.
Voila les feuilles où j'ai fait tous les calculs.
 J'ai aussi remarquer quelquechose, cela n'apparait malheuresement pas sur mes copies car au scan sa a "disparu" (j'avais écrit très légerement avec la mine ) : Lorsque l'on prend le dernière sous-couche d'une couche, et que l'y on ajout 4, puis que l'on ajoute le résultat a la couche, sa nous donne le couche d'après :
J'ai aussi remarquer quelquechose, cela n'apparait malheuresement pas sur mes copies car au scan sa a "disparu" (j'avais écrit très légerement avec la mine ) : Lorsque l'on prend le dernière sous-couche d'une couche, et que l'y on ajout 4, puis que l'on ajoute le résultat a la couche, sa nous donne le couche d'après :
Exemple :
On prend la sous-couche 1s^2 (c'est le ^2 qui nous intéresse) on y ajoute 4 (2+4=6) donc la prochaine sous (p) contiendra 6 électrons au maximum, et si on ajoute 6, a la couche (K)^2 (puisque l'on a utiliser 1s^2) sa donne 8, donc la couche électronique suivante pourrat conetnir au maximum 8 électrons, (L)^8.
Et sa marche avec toutes les couches : si nous sommes a n=4 (N), et que l'on prend sa dernière sous-couche (dans l'ordre croissant de l) (ici l=3) caractérisée par 4f^14 (puisque m peut prendre les valeurs de -3;-2;-1;0;1;2;3 (cf : 1er feuille), et que s=1/2 ou -1/2) et que l'on ajoute 4 a ^14, (18) alors la sous-couche suivantes contiendra ^18 électrons max. ; 5g^18, et si l'on ajoute se nombre (^18) a ^32 de (N)^32 on obtient 50, d'ou (O)^50 ! 
PS : je n'arrive pas a joindre mes feuilles...trop de ko