Inscription / Connexion Nouveau Sujet
DM: Hydroxyde d'aluminium
Voila, je voudrais que vous m'aidiez pour cet exo parce que je comprends rien a la physique et j'etais pas la pour ce chapitre!
Merci beaucoup!
** image supprimée **
Bonsoir
tu aurais quand même pu faire l'effort de taper ton énoncé et nous dire ce que tu as fait .
J'ai commencé à recopier le texte mais comme il y avait le graphe, j'ai du le scanner! désolé!
J'ai du m'absenter en cours pendant quelque temps et je dois faire ce dm alors que je n'ai toujours rien compris!
Déja je trouvais pas l'équation donc je commencais mal alors c'est pour ca que je vous ai demandé de l'aide.
On verse dans un bécher une solution de sulfate d'amonium,
2al3+ (aq) + SO4 2- (aq), contenant une quantité n1 d'aluminium.
On ajoute une solution d'hydroxyde de sodium, Na+ (aq) + HO- (aq), contenant une quantité n2 d'ions hydroxyde.
Un précipité blanc d'hydroxyde d'aluminium apparait. Les ions sodium et sulfate ne sont pas affectés pas la transformation.
1.Ecrire l'équation de la précipitation.
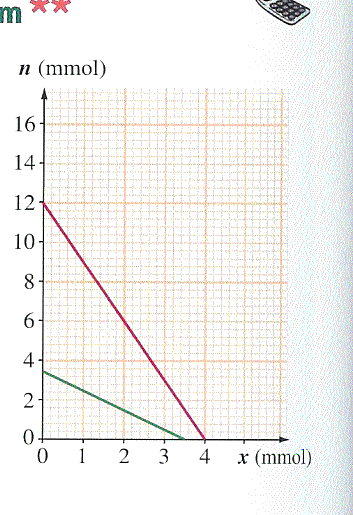
2. Identifier sur le graphe, les graphes représentant n(OH-) et n(Al+) en fonction de l'avancement.
3.Déterminer:
a.Les quantités initiales de chacun des réactifs.
b.L'avancement maximal et le réactif limitant.
c.La composition du système dans l'état final.
Merci
A l'etat initial on a n1 mol de Al3+ et n2 mol de HO-
En connaissant l'avancement, à un instant t queconque, on a n1-x mol de Al3+ et n2-3x mol de HO- 
D'accord merci beaucoup, et dcla courbe verte est celle de n(OH-) et la courbe rouge celle de n(Al3+) c'est ca?