Inscription / Connexion Nouveau Sujet
DM de physique
bonjour,
j'ai un exo de physique à faire et le prof va nous mettre une note dessus...j'aimerai savoir si mes réponses sont correctes:
On utilise les lampes à vapeur de sodium pour éclairer des tunnels routiers.Ces lampes contiennent de la vapeur de sodium à très faible pression.Cette vapeur et excitée par un faisceau d'électrons qui traverse le tube.Les atomes de sodium absorbent l'énergie des électrons.L'énergie est restituée lors du retour à l'état fondamental sous forme de radiations lumineuses.Les lampes à vapeur de sodium émettent surtout de la lumière jaune.
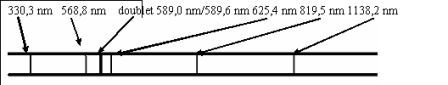
1 analyse du spectre d'émission d'une lampe à vapeur de sodium révèle la présence de raies de longueur d'onde  bien définie.
bien définie.
Spectre d'émission du sodium (v.pièce attachée)
1.1 Quelles sont les longueurs d'onde des raies appartenant au domaine visible?de l'ultraviolet? infrarouge?
-visibles: 568,8 nm; 615,4 nm; 589nm/589,6 nm
ultraviolet: 330,3 nm
infrarouge: 819,5 ; 1138,2
1.2 S'agit-il d'une lumière polychromatique ou monochromatique?justifier
-il s'agit d'une lumière polychromatique car il y a plusieures longueurs d'ondes.
Quelle est la valeur de la fréquence N de la raie de longueur d'onde  = 589,0 nm
= 589,0 nm
-  = c/N
= c/N
==> N= 589.10-9/3.108= 1,97.10-15 Hz
merci d'avance 
, correspond dans le vide ou dans l'air à une fréquence
et pas à ce que tu as écrit.
Sauf distraction 
Oui à quelques distractions près.
Tu as noté 615,4 nm au lieu de 625,4 nm pour une des raies visibles, il faut aussi noter le 0 derrière la virgule pour 589,0 nm (ce 0 est important car il fixe le nombre de chiffres significatifs).
Tu as oublié les unités (nm) pour les raies dans l'infrarouge.

est ce que vous pourriez juste jeter un coup d'oeil à la "suite" de cet exo ?
2. Le diagramme simplifié des niveaux d'énergie de l'atome de sodium représenté ci-dessous (v.scan)
2.1 On considère la raie jaune du doublet sodum de longueur d'onde  = 589,0 nm. Calculer l'énergie
= 589,0 nm. Calculer l'énergie  E ( en eV) qui correspond à l'émission de cette radiation. (On donnera le résultat avec le nombre de chiffres significatifs adapté aux données). En s'aidant du schéma, déterminer de quelle transition il s'agit.
E ( en eV) qui correspond à l'émission de cette radiation. (On donnera le résultat avec le nombre de chiffres significatifs adapté aux données). En s'aidant du schéma, déterminer de quelle transition il s'agit.
* En - Ep = 6,64.10-34.1,97.10-15 =1,30.10-48J
1,30.10-48J = 0,8.10-29 eV
On considère un atome de sodium dans l'état E1; cet atome reçoit une radiation lumineuse dont un quantum d'énergie  E' a pour valeur 1,09 eV.
E' a pour valeur 1,09 eV.
2.2 Cette radiation lumineuse peut-elle interagir avec l'atome de sodium? Justifier.
*j'ai pas du tout compris cette question si je pourrai avoir un indice pour commencer
2.3 On désire ioniser un atome de sodium dans l'état E2; quelle énergie doit-il absorber? quelle lumière doit on utiliser pour cela? préciser dans quelle partie du spectre se trouve cette lumière?
*Il doit absorber 1,94 eV ==> 3,11.10-19 J
E=h.N
==> N= E/h = 3,11.10-19/ 6,64.10-34= 4,68.1014 Hz
==> = 3.108/4,68.1014= 6,41.10-7
= 3.108/4,68.1014= 6,41.10-7
la lumière est visible car elle est de 641 nm et se situe entre 400 et 700 nm
merci d'avance 
2.1
Constante de PlancK : h = 6,626068 × 10^-34 (en unités SI)
Tu as toi: h = 6,64.10^-34, soit, c'est OK
Pour on a
et pas ce que tu as écrit.
On a donc
Avec , on a donc
-----
Pour le reste, comme ce n'est pas vraiment mon domaine, attendre la réponse de quelqu'un qui est sûr.
Sauf distraction 
2.1
Constante de PlancK : h = 6,626068 × 10^-34 (en unités SI)
Tu as toi: h = 6,64.10^-34, soit, c'est OK
Pour on a
et pas ce que tu as écrit.
On a donc
Avec , on a donc
-----
Pour le reste, comme ce n'est pas vraiment mon domaine, attendre la réponse de quelqu'un qui est sûr.
Sauf distraction 

 ...ca m'a beaucoup aidé parceque je m'étais un peu planté...
...ca m'a beaucoup aidé parceque je m'étais un peu planté...

