Inscription / Connexion Nouveau Sujet
Dm de Chimie
Salut, j'ai besoin d'aide pour un exercice de mon dm de chimie :
L'uranium U possède notamment les isotopes 235 et 238.
1. Les nombres 235 et 238 correspondent-ils au numéro atomique ou au
nombre de nucléons ? Justifier la réponse.
2. Calculer la masse de ces atomes à l'aide des données suivantes : mp =
1,67·l0-27 kg ; mn = 1,67·l0-27 kg ; me négligeable.
1) Je dirais que ce sont les nucléons (protons+neutrons), mais je sais pas comment justifier.
2) Je ne sais pas le faire ...
Pouvez-vous m'aider en m'expliquant ? Merci 
Bonjour,
1. Deux atomes isotopes ont le même numéro atomique Z mais des nombres de masse différents, donc un nombre de nucléons différents.
2.
Un atome se présente sous la forme
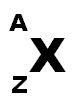
Il a donc
* Z protons
* Z électrons
* (A-Z) neutrons
Donc sa masse est m = Z*mp + (A-Z)*mn + Z*me
On néglige la masse des électrons donc
m  Z*mp + (A-Z)*mn
Z*mp + (A-Z)*mn
A.N :
m = ........ kg
Merci  . Mais A = Protons et Z = neutrons, c'est ça ? Après ta reponse, je ferais le calcul et je le posterais ici, pour savoir s'il est correct
. Mais A = Protons et Z = neutrons, c'est ça ? Après ta reponse, je ferais le calcul et je le posterais ici, pour savoir s'il est correct 
A est le nombre de masse donc des protons et des neutrons.
Z = nombre de protons = nombre d'électrons
Si j'ai compris, ça donne : Z*mp+(A-Z)*mn = 92*1,67*10.-27 + (238-92)*1,67.10-27 = environ 3.9.10-25

 ...
...
