Inscription / Connexion Nouveau Sujet
Devoir-Maison Masse Molaire,etc..
Bonjour tout le monde.
J'ai un Devoir-Maison en physique à faire mais j'ai du mal à certaines questions donc je viens demander votre aide.
On me demande à une question : A quoi correspond les deux colonnes sur l'étiquette ?(je pense que c'est les ions monoatomique et polyatomique qui sont séparés,c'est bien cela?
Ci-dessous l'étiquette en question.
J'aurai également besoin d'aide pour les questions suivantes :
-Déterminé la masse molaire de tous les ions indiqués(Je dois calculer la masse de tous,sauf la silice car en solution aqueuse ce n'est pas sous forme d'ions c'est bien ça?)
-Pour un litre de solution,calculer la quantité de matière de chacun des ions contenus dans cette eau(Comment faire? Je ne comprend pas..)
-Calculer la quantité de matière totale des charges positives.(si un ion possède une charge+,on compte une fois sa quantité,S'il possède 2 charges+,il faut la compté deux fois)Je dois additionner les quantités de matière en fonctions du nombre de charge c'est ça? Par exemple pour Le potassium,noté K+ je dois additionner une fois sa quantité de matière,c'est bien cela?
-De même,calculer la quantité de matière totale des charges négatives(La même chose que plus haut)
-Vérifier la neutralité électrique de l'eau minérale(Vérifier qu'il y a autant de + que de - )
Merci beaucoup de votre aide,dites moi si c'est bien cela et s'il vous plait aidez-moi,Bonne journée.
Edit Coll : image recadrée
Ha mais oui tu as absolument raison! Je viens de m'en rendre compte.. Tout ceux de gauche sont positifs car ils ont perdu ou gagné un ou plusieurs électrons. A gauche c'est l'inverse..Merci beaucoup de m'avoir ouvert les yeux!
Peux-tu m'aider pour la suite s'il te plait?
Merci beaucoup encore une fois!
Déterminé la masse molaire de tous les ions indiqués(Je dois calculer la masse de tous,sauf la silice car en solution aqueuse ce n'est pas sous forme d'ions c'est bien ça?)
qu'appelles tu Silice?
Ben sur la fiche de l'eau minérale il y a marqué qu'en solution aqueuse,la silice n'est pas sous forme d'ion.
Je n'ai pas plus d'infos.
ok
pour les autres:
Calcium = Ca
Magnésium = Mg
Sodium = Na
Potassium = K
Bicarbonate = HCO3-
Sulfate = SO42-
Chlorures = Cl-
Nitrates = NO3-
ensuite, petit rappel:
Masse molaire d'un ion
La masse des électrons est négligeable devant la masse de l'atome.
La masse molaire d'un ion monoatomique est la masse d'une mole de ces ions monoatomiques, elle est égale à la masse molaire de l'atome correspondant.
La masse molaire d'un ion polyatomique est la masse d'une mole de ces ions polyatomiques,elle est égale à la somme des masses molaires des atomes le constituants.
tu as besoin aussi de la classification période des éléments pour avoir la masse molaire de chaque élément.
Pour la masse molaire de tous les ions indiqués,je dois en fait calculer la masse molaire atomique c'est bien ça?
la masse molaire atomique et la masse molaire moléculaire. Le résultat en g/mol
pour t'aider
Calcium = Ca => masse molaire MCa = 40.1 g/mol
Magnésium = Mg => masse molaire MMg = 24.3 g/mol
etc...
D'accord je pense avoir comprit.
La masse molaire du sodium est 23.0g/mol
La masse molaire du potassium est 39.1g/mol
La masse molaire du Bicarbonate est : M(HCO3-)=1M(H)+1M(C)+1M(O)=1x1.0+1x12.0+1x16.0= 29g/mol
La masse molaire du Sulfate est : M(SO42-)=1M(S)+1M(O)=1x32.1+1x16.0= 48.1g/mol
La masse molaire du Chlorure est : M(Cl-)=1M(Cl)=1x35,5= 35.5g/mol
La masse molaire du Nitrate est : M(NO3-)=1M(N)+1M(O)=1x14.0+1x16.0= 30g/mol
C'est bien ça?
La masse molaire du sodium est 23.0g/mol (oui)
La masse molaire du potassium est 39.1g/mol (oui)
La masse molaire du Bicarbonate est : M(HCO3-)=1M(H)+1M(C)+1M(O)=1x1.0+1x12.0+1x16.0= 29g/mol (non, c'est 1M(H)+1M(C)+3M(O))
La masse molaire du Sulfate est : M(SO42-)=1M(S)+1M(O)=1x32.1+1x16.0= 48.1g/mol (non, c'est la même remarque que pour le bicarbonate)
La masse molaire du Chlorure est : M(Cl-)=1M(Cl)=1x35,5= 35.5g/mol (plus proche de 35,45 g/mol)
La masse molaire du Nitrate est : M(NO3-)=1M(N)+1M(O)=1x14.0+1x16.0= 30g/mol (non, c'est la même remarque que pour le bicarbonate)
La masse molaire du Bicarbonate est:M(HCO3-)=1M(H)+1M(C)+3M(O)=1x1.0+1x12.0+3x16.0= 61g/mol
La masse molaire du Sulfate est M(SO42-)=1M(S)+4M(O)=1x32.1+4x16.0= 96.1g/mol
La masse molaire du Nitrate est :M(NO3-)=1M(N)+3M(O)=1x14.0+3x16.0= 62g/mol
C'est bon là?
D'accord Merci beaucoup Lolo60,tu peux m'aider pour la suite s'il te plait?
Pour un litre de solution,calculer la quantité de matière de chacun des ions contenus dans cette eau. Que dois-je faire là?
On cherche une quantité de matière n en moles.
Sur l'étiquette, on te donne la concentration (en mg/L) de chaque ions
Ta solution a un volume d'un litre
Si tu multiplies la concentration de chaque ions (mg/L) par le volume de ta solution (1L), tu vas obtenir des mg
ensuite pour obtenir des moles, tu divises cette masse par la masse molaire de l'élément que tu as calculé à la question précédente.
Tu peux me donné un exemple?
N=m/M
Donc par exemple pour le bicarbonate : 360/61=5.9 à peu près. C'est bien ça?
c'est
n = m/M
n = nombre de moles
m = masse (g)
M = masse molaire (g/mol)
pour le bicarbonate:
n = m/M
sa concentration dans l'eau est de 360mg/L, comme la solution a un volume d'1L, il y a 360mg soit 0.36g dans un litre
donc
n = 0.36/61 = 0,0059 mol soit 5.90 mol
J'ai oublié de convertir...
Je fais tout les calculs et je le publie,tu me dis si c'est juste pour voir si j'ai bien comprit d'accord?
Je le fais vite!
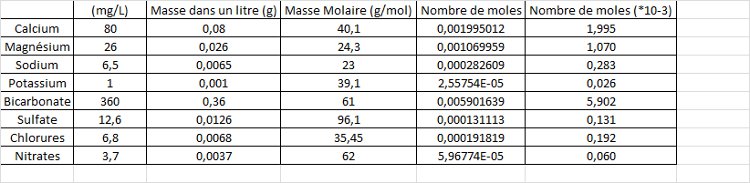
Pour le Calcium : n=m/M donc : 0.080/40.1=0.0019 soit 1.9x10-3mol
Pour le Magnésium : n=m/M donc : 0.026/24.3=0.0010 soit 1x10-3mol
Pour le Sodium : n=m/M donc : 0.0065/23=0.00028 soit 0.28x10-3mol
Pour le Potassium : n=m/M donc : 0.001/39.1=0.000025 soit 0.025x10-3mol
Pour le Bicarbonate : n = 0.36/61 = 0,0059 mol soit 5.90x10-3mol
Pour le Sulfate : n=m/M donc : 0.0126/96.1=0.00013 soit 0.13x10-3mol
Pour le Chlorure : n=m/M donc : 0.0068/35.45=0.00019 soit 0.19x10-3mol
Pour le Nitrate : n=m/M donc : 0.0037/62=0.000059 soit 0.059x10-3mol.
C'est bon?
On prend 3 chiffres après la virgule alors? Par de soucis.
Pour la suivante : Calculer la quantité de matière totale des charges positives.(si un ion possède une charge+,on compte une fois sa quantité,S'il possède 2 charges+,il faut la compté deux fois). Je dois additionner les matières de chaque ions qui a une charge positive,si elle a 2 charger je dois la compter deux fois,c'est bien cela??
tu peux laisser deux chiffres apres la virgule
Je dois additionner les matières de chaque ions qui a une charge positive,si elle a 2 charger je dois la compter deux fois,c'est bien cela??
oui
en écriture scientifique :
-pour le sodium : 2,8x10-4mol
-pour le potassium : 2,5x10-5
-pour le sulfate : 1,3x10-4
-pour le chlorure : 1,9x10-4
-pour le nitrate : 6,0x10-5 (attention à l'arrondi)
sinon c'est bon
Donc j'additionne Ca2+ x 2 + mg2+ x2 + Na+ + K+ pour les positifs
Pour les négatifs : HCO3- x1 + SO4 2- x 1 + Cl- + NO3- x1
C'est bon pour tout ça?
Pour les positifs : 1.995x10-3 x2 + 1.070x10-3 x 2 + 0.283x10-3 + 0.026x10-3 = 0.00399 + 0.00214 + 0.000283 + 0.000026=0.006439mol qu'elle unité? Faut pas convertir?
0.006439mol représente la quantité de matière totale des charges positives, une quantité en mol
fais de même pour les charges négatives
Pour les négatifs : 5.902x10-3 + 0.131x10-3 + 0.192x10-3 + 0.060x10-3 = 0.005902 + 0.000131 + 0.000192 + 0.00006 = 0.006285mol?