Inscription / Connexion Nouveau Sujet
Rohhh tu me cherches toi ! Je sais que je ne suis pas très forte en maths mais tout de même 
en clair il est impossible de représenter un ion sous la représentation de Lewis
merci a toi lyonnais
il ya peut etre une autre réprésentation faite par un célèbre homme qui permet de représenter les ions polyatomiques
eh non il est possible de représenter des ions sous Lewis la preuve je viens de trouver par exemple O2-
oui je les trouver sur un site la méthode
si tu veux y aller tu va sur google tu tape représentation d'ions polyatomiques et tu prends le premier sit qui s'apelle Géométri
Merci 
P.S : c'est niveau terminale ? parce que ca n'a pas l'air si compliquer que sa, sauf si sa ce complique beaucoup pour d'autre atome
est ce juste ce que j'ai fait encore une fois lyonnais pourrais tu me dire si j'ai raison ou pas
merci d'avance
que 20%
lol
cela représente 4 jours de recherche!
on va bien finir par trouver
mimick , chaque lien compte pour une paire d'électron autour de ton atome, donc ton image est correct, mais aucun n'atome ne doit avoir de ligne, car une ligne représente 2 atomes libres autour de l'atome.
Ainsi, regarde l'image
l'atome N a 8 électrons autour de lui (4 liens de 2e- partagée avec les H) et les H ont tous 2 e- (1 lien avec le N)
Comprends-tu maintenant comment faire ?
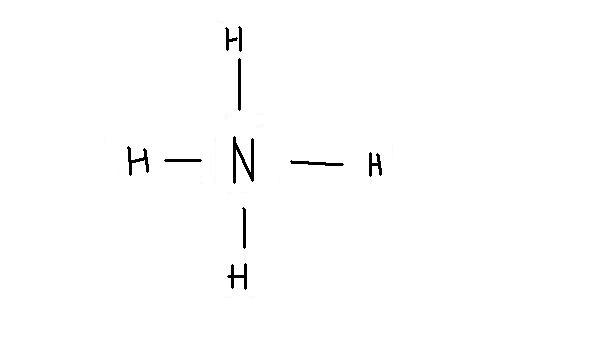
et ta représentation existe?
si oui donc l'atome N a 4 doublet liant au lieu de 3!!
oui, pcq N est un atome qui doit respecter la regle de l'octet, donc il peut avoir au maximum 4 liens (connais-tu les orbitales ?¸si oui, je peux t'expliquer pourquoi c'est 4, sinon prend le pour acquis)
myka : nous sommes tous les deux en seconde  , donc moi personelement les orbitale, je connais pas ( pour l'instant ! )
, donc moi personelement les orbitale, je connais pas ( pour l'instant ! )

ORBITALE :
En physique nucléaire, partie de l'espace situé autour du noyau de l'atome, où la probabilité de présence de l'électron est la plus importante.
... 
tu n'as qu'a mettre un - a coté du N
et pour calculer si le N est négatif et quel est sa charge, tu dois calculer la charge formelle de la molécule
N a 5 e-
chaque H a 1 e-
donc il y a 5+4*1 = 9e- autour du N, donc il est négatif(-), car 8 - 9 = -1 comme charge sur le N
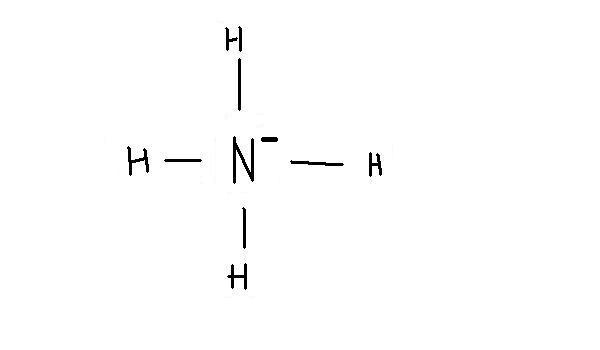
heu... "
donc il y a 5+4*1 = 9e- autour du N, donc il est négatif(-), car 8 - 9 = -1 comme charge sur le N "
ce n'est peut etre pas le cas de mimick mais j'ai du mal la 
je ne comprends pas ta question,
Qu'est-ce qui ne marche pas avec ma réponse ?
on ma dit que pour représenter cette ion NH4- il fallait utiliser des hexagones!!
si tu veux la représentation de Lewis, c'est ce que j'ai fait plus haut !
mais si c'est une autre représentation que tu désires c'Est diférent...
ha ?
mais deja, myka : ton N a 5 e- avec ses doublet liant sa fait 4 + son ptit "moin" ( N[sup][/sup] ) sa fait 5 ?
et aprés on fait 5 + 4 × 1 >>> pourquoi 4 × 1 ?
aprés " Donc i est négatif " pourquoi il est négatif ? tu dis Car 8-9, mais ou tu trouve les 8 ?
lol merci beaucoup sinon 
k, l'azote est une molécule qui respecte la règle de l'octet, donc elle doit essayer de garder 8 électron autour d'elle pour avoir une charge net nulle. (meme chose pour le C, le O, ...)
5 + 4 x 1
ça correspond a calculer les 5 e- de N et les 4 e- qui sont mis en contact avec N (pour former la molécule) qui viennent des H
mais deja, myka : ton N a 5 e- avec ses doublet liant sa fait 4 + son ptit "moin" ( N ) sa fait 5 ? tu as raison, mais dans des molecules plus complexe, calculer la charge peut etre plus facile
Bas et l'ion C2H5+, je suis pas sur que ce soit un simple + corrigésmoi au cas ou... )
on le dessine comùment lui ?




