Inscription / Connexion Nouveau Sujet
contrôle
vous êtes superbe !!! merci infiniment =D
pourriez vous me corriger cet exercice sur la stchiométrie (il doit y avoir beaucoup de fautes =$ ) Merci 
exercice : CH4 + 2O2 ----> CO2 + 2H2O
C6H12O6 + O2 ---> CO2 + 6H2O
2AL + 3O2 ---> AL22O3
C4H6 + 2CL2 ---> C4H6CL4
C6H6 + HNO3 ---> C6H3N3O6 + 3H2O
2FeCL3 + 3MGO ---> Fe2O3 + 3MGCL2
ps : en gras italique et souligné c'est ce que j'ai ajouté pour équilibrer l'équation
voici la suite de l'exercice : ( je ne l'ai pas fait car je n'ai rien compris ) merci de bien vouloir m'aider
*** message déplacé ***
Bonjour,
La première est juste
2) Faux : il n'y a pas autant de C de chaque côté.
3) Faux : Tu ne peux pas rajouter un trois venu de nul part à l'intérieur d'une formule brute sinon ce n'est plus la même molécule.
4 Al + 3 02 => 2 Al2O3
4) Ok
5) Faux : Il n'y a pas autant de N de chaque côté
6) Ok
Il faut aussi équilibrer pour la suite :
1) On ne change rien
2) Idem
3) Il faut équilibrer : 2 H2C03 + 2 H20 => 2 HCO3- + 2 H30+
4) Il faut aussi équilibrer
ok merci beaucoup MelleAlmeida
mais je crois que je n'ai pas très bien compris cette leçon donc il est très difficile pour moi de comprendre justement
pourquoi cela est juste ou cela est faux ...
je suis désolée , je suis vraiment nulle 
Il ne faut pas s'en vouloir comme ça, on est là pour apprendre et si on connaît tout alors on n'a rien à faire à l'école ^^
C'est juste une question de pratique, à force de s'entraîner, on s'améliore et on réussit, tout vient à point à qui sait attendre ^^
Ok, Prenons la 2ème équation :
C6H12O6 + O2 ---> CO2 +6H2O
Au début on a :
-C : 6
-H : 12
-O : 8
A la fin on a :
-C : 1
-H : 12
-O : 8
On voit bien que d'un côté on a 6C et de l'autre 1C, ce n'est donc pas équilibré.
On rajoute donc 6C à la fin :
C6H12O6 + O2 ---> 6CO2 +6H2O
Au début on a :
-C : 6
-H : 12
-O : 8
A la fin on a :
-C : 6
-H : 12
-O :18
Maintenant, ce sont les O qui ne sont pas équilibrés donc on continue :
C6H12O6 + 6O2 ---> 6CO2 +6H2O
Au début on a :
-C : 6
-H : 12
-O : 18
A la fin on a :
-C : 6
-H : 12
-O :18
Ainsi, l'équation équilibrée est : C6H12O6 + 6O2 ---> 6CO2 +6H2O
Voilà la "méthode" et puis ça fonctionne pareil pour le reste.
merci pour ton explication qui m'a été précieuse ( je peux te tutoyer ?)
une petite question ... on n'a pas le droit de mettre un multiple à l'intérieur d'une molécule ?( pour un atome donné)
alors pourquoi on compte le nombre de chaque atome de la molécule ?
Naturellement, on peut se tutoyer, je dois avouer que c'est beaucoup mieux ^^
"On n'as pas le droit de mettre un multiple à l'intérieur d'une molécule ?" Oui.
=> Un exemple :
Cr2O42- c'est l'ion chromate
Cr2072- c'est l'ion dichromate
Si on ajoutes un cfficient "dans la molécule"(ici c'est un ion mais c'est pareil pour une molécule), on voit bien que que celle ci n'est plus la même, ce sont deux entités chimiques différentes.
On compte le nombre d'atome de chaque molécule pour pouvoir équilibrer l'équation. On va dire que c'est plutôt quelque chose de mentale c'est-à-dire que ce que j'ai écris c'est un peu la façon dont on doit réfléchir, du moins, c'est la mienne, d'une personne à une autre, c'est parfois différent.
Puis, le fait de compter le nombre d'atomes ne modifie en aucun cas la molécule.
donc oui on a le droit
ou non on'a pas le droit ? hihih
par exemple FeCl3 on a le droit de faire Fe3Cl3 ?
et pour la compte
par exemple si on a CO2
on 2 O et 2 C ou juste une molécule de CO2 ?
merci
et si on a
C6 H12 06 c'est une molécule ?
on a le droit de mettre un multiple que pour C6 ou se multiple va avec le reste de la molécule ?
désolée mais pour l'autre exercice que j'ai photographié .
ZN2+ = 2+ c'est la charge ? ou la quantité de ZN
et si c'est la charge comme puis je résoudre cette équation
Zn + Cu(2+) ----> ZN(2+) + CU
ajustée = ZN (2+) + CU(2+) ----> ZN(2+) + CU(2+)
et si c'est ça bah je comprend pas XD
et dernière faveur s'il te plaît !
correction de l'exercice photographié :
ZN (2+) + CU(2+) ----> ZN(2+) + CU(2+)
2CO ---> CO2 + C
2H2CO3(-) + 2H2O(+)-----> 2HCO3(-) + 2H3O(+)
4PB(2+) + 4I(4-) ----> PBI4(2-)
ce que j'ai fait : en souligné
merci de bien vouloir me le corriger 
WOW ! Beaucoup de questions !
1) Par exemple FeCl3, on a le droit de faire Fe3Cl3 ?
C'est "interdit" de faire ça !
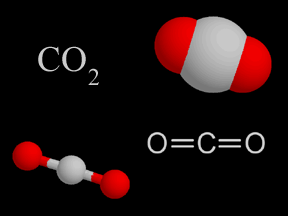
2) Par exemple si on a CO2 on a 2 O et 2 C ou juste une molécule de CO2 ?
>> On a une molécule de CO2
>> Dans la molécule de CO2 tu as 1 atomes de carbone et 2 atomes d'oxygène (cf image) donc ce qui est en gras dans la question est faux.
3) C6H12O6, C'est une molécule ? On a le droit de mettre un multiple que pour C6 ou ce multiple va avec le reste de la molécule ?
C6H12O6 est une molécule de glucose présente dans le sucre.
Si on met un multiple devant la molécule : ex: 2 C6H12O6,
alors on multiplie chacun des atomes de la molécule par deux (sans modifier la molécule) pour compter le nombre d'élément, de chaque atome.
Pour notre exemple la molécule de glucose contient donc (avec le cfficient) soit dans 2 C6H12O6:
On a : 12 C, 24 H et 6 O.
donc si j'ai bien compris
Si on 6 CO2
ça fait 6atomes de carbone et 12 atomes d'oxygène ?
et mon exercice est il bon ?
je commence à comprendre
tu expliques vraiment bien bravo 
En revanche il faut faire un petit un effort dans la notation.
Ce n'est pas ZN mais Zn et non pas CU mais Cu.
Dans l'ion Zn2+, 2+ c'est la charge.
Attention Zn et Zn2+ sont différents, on ne peut pas rajouter de charges !
Zn + Cu2+  Zn2+ + Cu
Zn2+ + Cu
Au début, on a :
Éléments : 1 Zn et 1 Cu
Charges : 2 charges positives (2+)
A la fin, on a :
Éléments : 1 Zn et 1 Cu
Charges : 2 charges positives (2+)
Donc il n'y a rien à modifier l'équation est équilibrée !
2CO  CO2 + C, c'est juste.
CO2 + C, c'est juste.
2H2CO3- + 2H2O+ 2HCO3- + 2H3O+, c'est faux.
2HCO3- + 2H3O+, c'est faux.
Réponse :2H2CO3 + 2 H2O 2HCO3- + 2H3O+
2HCO3- + 2H3O+
Information : les charges contraires s'annulent entre elles.
4 Pb2+ + 4I4- PbI42-, c'est faux.
PbI42-, c'est faux.
je crois que je t'en demande trop mais pourrais tu expliquer pourquoi j'ai faux s'il te plaît
merci beaucoup 
Ok.
Il faut équilibrer les éléments sans se soucier des charges comme on l'a fait précèdemment.
Équation : H2O3 + 2 H2O ==> HCO3- + H3O+
Au début : 6H et 5O
A la fin : 4 H et 4O
Ainsi on ajuste ne nombre de H :
2 H2O3 + 2 H2O ==> 2 HCO3- + 2 H3O+
Et puis on se rend compte que les O aussi sont ajustés.
Au début :
Elements : 8H et 8O
Charges : aucune
A la fin :
Eléments : 8H et 8O
Charges: 2+ et 2- = O car les charges de signes contraires s'annulent.
Donc c'est équilibré.
Désolée si j'ai tardé à répondre.
Je vais écrire correctement les équations :
**Équation : H2O3 + 2 H2O ==> HCO3- + H3O+
**Équation équilibrée : 2 H2O3 + 2 H2O ==> 2 HCO3- + 2 H3O+
non non ne soit pas désolée  je suis vraiment contente que quelqu'un m'aide
je suis vraiment contente que quelqu'un m'aide 
euh je crois qu'au départ c'était H2C03 mais ça change quelque chose ?
donc pour la 4
au début: 1 Pb et 1 I
2 charges positives et 1 charge négative
à la fin : 1Pb et 4 I ou 1 PbI ou 4Pb et 4 I
2 charges négatives
donc ça fait ... ( j'en sais rien après ça dépend si mon analyse est correct )
Non. C'est juste moi qui ai oublié le C ^^
Au début :
Éléments : 1 Pb et 1 I
Charges : 2+ et 1- donc le total : 1+
A la fin :
Éléments : 1 Pb et 4I
Charges : 2-
Oui ça ne change rien.
Il ne faut jamais rajouter des charges.
I- et I4- c'est différent, d'ailleurs I4-, je ne suis pas sûre que cela existe.
Quand tu mets un multiple devant du genre 4I-
ça signifie qu'il y a 4I et 4 charges négatives.
Équation finale : Pb2+ + 4 I- ----> PbI42-
Au début :
*1 Pb et 4 I
*charges 2+ et 4- = 2- (au total)
A la fin :
*1Pb et 4I
*charges : 2-
D'acccccccoooooooorrrrrdddddd j'ai compris
bah mon intention était assez bonne :-$
youppii merci beaucoup
MelleAlmeida !! je crois que sans vous(toi) je n'aurais jamais pu comprendre !
franchement bravo ! car j'ai vu que tu n'étais qu'en terminale
très bonnes explications ( mieux qu'un prof )
ps : je te dis bonne chance pour le bac 
merci encore 


