Inscription / Connexion Nouveau Sujet
contrôle
bonjour
je vais avoir un contrôle en physique sur la structure électronique(règle du duet et de l'octet), sur le poids et la masse et enfin sur les molécules(liaison)
pourriez vous m'indiquer les points les plus importants de chaque leçon
et si possible me mettre des exercices de ce type
je vous en serai très reconnaissant
merci 
La structure électronique :
Remarques :
Lorsque les atomes subissent des transformations (en ion ou en molécules), ils le font de façon à saturer ou pseudo-saturée leur couche externe.
Les atomes "chimiquement stables" sont ceux dont la couche externe est déjà saturée.
Règle du duet-octet
Au cours de leur transformation chimique, les atomes caractérisés par Z < 5 (Z : numéro atomique) évoluent de manière à avoir un "duet" (2 électrons) sur leur couche externe ([L], [M], ...)
Ex : 168O
Ses couches : (L)2 (M)6
Pour être stable, il a deux choix :
* prendre 2 électrons pour avoir (L)2 (M)8
* perdre 4 électrons pour avoir (L)2 (M)2
L'atome choisit la facilité, il capte 2 électrons donc il sature sa couche (M) avec un octet.
merci beaucoup MelleAlmeida pour ces explications
je crois que la masse le poids je m'en sors pas trop mal
donc ça serait plutôt les molécules
exemple chaîne ramifiée / linéaire/ cyclique
forme développée / semi développé / brute et surtout la stchiométrie !!
merci à vous 
En revanche si un point n'est pas clair sur ce que j'ai déjà dit, il faut me le préciser.
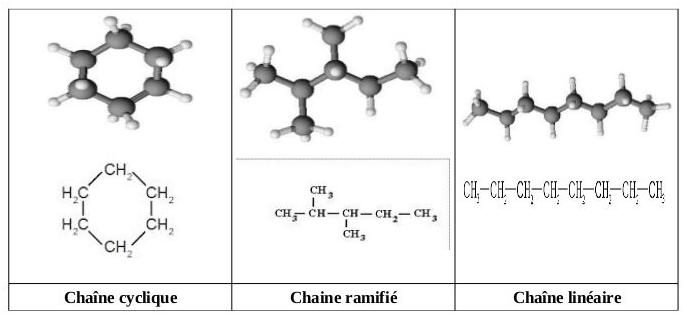
Structure des molécules organiques :
Une molécule organique est constituée d'une chaîne d'atomes de carbone reliés entre eux : c'est la chaîne carbonée.
cf image.
Le type de chaîne carbonée influe sur les propriétés physiques (température de fusion, d'ébullition, etc)
Pour les formules développées, toutes les liaisons apparaissent :
exemple octane : https://upload.wikimedia.org/wikipedia/commons/3/3c/Octane-d.GIF
exemple éthène : http://upload.wikimedia.org/wikipedia/commons/thumb/8/8d/Ethene-2D-flat.png/220px-Ethene-2D-flat.png
Pour les formules semi-développées, les liaisons C-H ne sont pas écrites :
exemple octane : https://upload.wikimedia.org/wikipedia/commons/4/4f/Octane_sd.GIF
exemple éthène : H2C=CH2
Pour les formules brutes, on donne le nombre d'élément :
Octane : C8H18
Ethène : C2H4
Pour équilibrer une équation
Il faut qu'il y ait autant d'éléments au début et à la fin de la réaction, de même pour les charges.
ex : H2 + Cl2 => HCl
On voit qu'au départ on a 2 H et 2 Cl donc il faut 2 H et 2 Cl à la fin également :
H2 + Cl2 => 2 HCl
ex n°2 : NH3 + O2 => NO + H2O
Au début on a : 1N, 3H, 2O
A la fin on a : 1N, 2O, H2
Il faut équilibrer les H
2 NH3 + O2 => NO + 3 H2O
Au début on a : 2N, 6H, 2O
A la fin on a : 1N, 6H, 4O
Il faut équilibrer les N dans un premier temps
2 NH3 + O2 => 2 NO + 3 H2O
Au début on a : 2N, 6H, 2O
A la fin on a : 2N, 6H, 5O
Il faut équilibrer les O à présent :
2 NH3 + (5/2) O2 => 2 NO + 3 H2O
Au début on a : 2N, 6H, 5O
A la fin on a : 2N, 6H, 5O
L'équation est donc équilibrée, mais on évite en général d'avoir des quotients comme cfficients donc on multiplie le tout par 2 :
(2 NH3 + (5/2) O2 => 2 NO + 3 H2O)*2
4 NH3 + 5 O2 => 4 NO + 6 H2O
Et voilà l'équation finale.
En seconde, si on ne multiplie pas par 2, c'est pas bien grave.
Une équation avec des charges :
H2SO4 + H2O => H3O+ + SO42-
On équilibre les éléments de chaque côté :
Au début : 4H, 1S, 5O
A la fin : 3H, 1S, 5O
On équilibre les dans un premier temps les H
H2SO4 + 2H2O => 2H3O+ + SO42-
Au début : 6H, 1S, 6O
A la fin : 6H, 1S, 6O
Au début : aucune charge
A la fin : les charges s'annulent
L'équation finale est ainsi H2SO4 + 2H2O => 2H3O+ + SO42-


