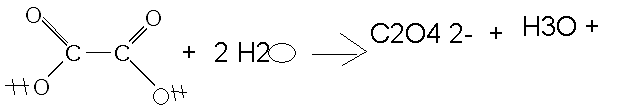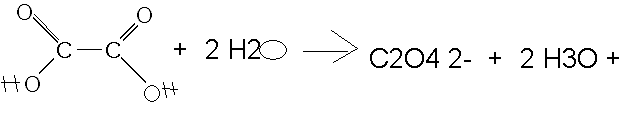Inscription / Connexion Nouveau Sujet
chimie acide oxalique
Alors voilà, j'ai un tp de chimie a rendre et c'est vraiment compliqué.
La prof me demande d'écrire la réaction de l'acide oxalique avec l'eau à partir de la formule que je vous ai dessiné.
De plus, je dois déterminer la Concentration en ion HO- de la soude.
Mes données sont : concentration de l'acide oxalique = 5,0 x 10-2 mol x L-1
Masse molaire acide oxalique = 126.07 g x mol-1
Chute de burette = volume NaOH = 9.98 mL
Volume acide oxalique = 10 mL
Aider moi svp c'est très important je suis totalement perdu... merci
L'acide oxalique est un diacide, donc une molecule d'acide réagit sur 2 molécules hydroxydes, à partir de là tu peut trouver l'équation chimique. On verra la suite après. Ecris cette équation.
Le problème c'est que je ne comprend pas comme écrire la suite.
Tu pourrais m'aider?
Ca me parrait bizarre que ta prof t'es donné ça (tu es bien en 2nde ?)
Bon alors on forme uniquement des ions oxonium et l'ion oxalate (C2O42-
vas y.
je me suis trompé de forum ... je suis en première mince, bon bref. ..
C'est ça?
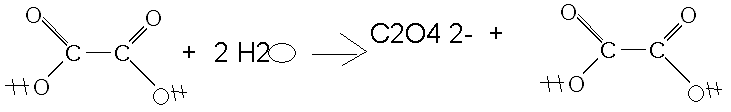
Mais comment tu sais que c'est ces ions qui sont formés?
Je le sais car un "acide faible" + "eau" donne toujours "base faible issue de l'acide" + "ion oxonium"
c'est la règle.
j'essaye d'être la pour qu'on continu. C'est vraiment très gentil de ta part. ++
voila donc si j'ai bien compris, je peux écrire ça ce qui est plus correcte.
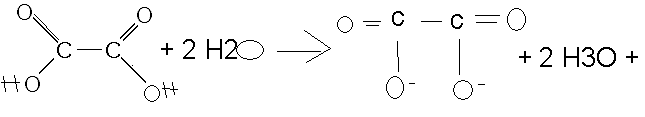
il faut faire ça pour calculer la concentration en ion HO-, parce que j'ai réfléchi cette après-midi et j'ai trouvé un début en faisant les équations de dissociation de la soude et de l'acide oxalique
ok, donc voila :
D'après les équations :
-de dissociation de la soude : Na+ + HO-
-de dissociation de l'acide oxalique : voir le schéma
==> j'ai trouvé ça en raisonnant ainsi: l'acide oxalique est un diacide. Il est donc capable de céder 2 protons. Un acide réagit avec une base. La base est ici la soude. Dans la soude, il n'y a que les ions HO- qui sont basique. Donc l'acide oxalique réagit avec 2 HO-.
Qu'en penses tu?
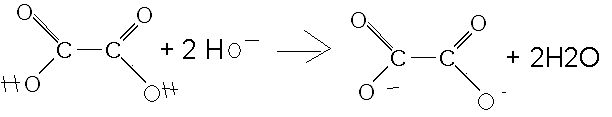
TRES BIEN !! bravo.
Maintenant il va falloir calculer la concentration de la soude. Est ce que tu vois comment faire ?
en général, on traduit les équations de dissociation par n... = n ...
Et ensuite d'après la concentration molaire on obtient
C .. x V ... = C .. x V ...
Mais la je ne vois pas vraiment comment commencer
Oui en fait en général on écrit nacideinitial=nbaseintroduit par la burettte
Sauf que ici ça ne marche pas ! Car on a un diacide !
Et comme tu l'as écrit une molécule d'acide oxalique consomme 2 molécules d'hydroxyde (c'est ton équation)
Donc ici on a :
2 x nacideinitial=nbaseintroduit par la burettte
Si tu ne vois pas pourquoi, tu vas faire le tableau d'avancement.
C'est au programme de 1ère, si tu l'as pas fait ça va pas tarder...
Et sinon l'equation 2 x nacideinitial=nbaseintroduit par la burettte ça va ?
Je vais pas tarder à aller manger(j'attends encore un peu que ça chauffe), si tu veux t'ecriras ton résultat, et je te posterais un message pour te dire si c'est bon ou pas
en fait ça découle de :
nHO- = 2 nH3O+ ?
non ici il n'y a pas de H3O+ (regarde ton équation)
c'est pas H3O+ c'est ....
Bon c'est chaud. Je reviens dans 15 minutes. Sinon il faut utiliser C=n x V et c pas H3O+ mais C2O42-
ok ben j'essaye je t'envoie ce que je trouve pis tu réponds quand tu peux si c'est pas aujourd'hui c'est pas grave le tp est a rendre pour mercredi j'aimerai le finir ce w-e mais je pense que j'aurais le temps.
Bonne appétit a + tard ou a demain je pense
Donc nHO- = 2n C2O42-
J'appelle l'acide oxalique H2S
nHO- = 2nH2S
D'après la concentration molaire:
C HO- x V HO- = 2 x C H2S x V H2S
C HO- = ( 2 x C H2S x V H2S) / V HO-
C HO- = ( 2 x 5.0 x 10-2x 10) / 9.98
C HO- = environ 0.1002 mol x L-1
C'est possible?
C'est ça, mais...
- je sais pas si tu l'as fait exprès ou pas mais tu as oublié de convertir les volumes en L, tu as de la chance car ici dans ton calcul ça ne change pas le résultat.
- Il y a trop de chiffres significatifs !!
-D'autre part, si c'est un TP a rendre, il faudra que tu justifies d'où sort l'équation :
2 x nacideinitial=nbaseintroduit par la burettte
Tu vas pas dire à ta prof "c'est isaac newton qui me l'a dis !!"
Bon courage !!
Je consulterais ce forum demain maintant si t'as d'autres questions.
j'ai exprés laissé les volumes en mL car ça s'annulé je l'ai fait exprès!
Sinon il reste une dernière question sur le tp je la mettrai en ligne demain d'abord je vais réfléchir dessus ce soir !!
Bonne soirée merci pour tous à demain alors ++
Dsl pour ce w-e mais je n'étais pas dispo !
J'ai arrivé à traiter la dernière question toute seule et voilà j'ai fini je voulais juste te remercier de ton aide ça m'a beaucoup servi.
Si j'ai un problème je sais que je peux faire appel à toi
Bonne soirée ++