Inscription / Connexion Nouveau Sujet
Vitesse instantanée de formation de diiode
Salut à tous,
J'ai un petit souci pour comprendre le corrigé d'un exo :
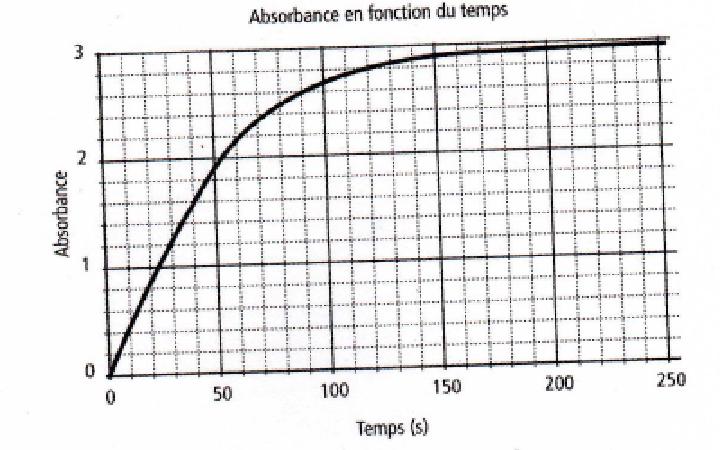
Il s'agit d'une mesure de l'absorbance en fonction du temps entre l'eau oxygénée et les ions iodure, j'ai le graphe ci joint,
On me demande dans un premier temps de déterminer la vitesse de réaction v en fonction de l'absorbance, bon
On a : 1/V * dx/dt = 1/V * dnI2/dt = d[I2]/dt car V est constant, d'où v = 1/k *dA/dt
Ensuite, on me demande de déterminer la vitesse instantanée de formation du diiode à t = 50s ; et là je bloque
J'ai pas mal cherché, j'ai d'abord trouvé qu'à t = 50s ; le coefficient directeur de la tangente est (2,6-1,6)/(80-30) = 1/50 s. Bon, là on a un temps. Maintenant, il faut trouver la vitesse de formation de diiode par rapport à ce temps, comment s'y prendre alors par rapport à l'absorbance ?
Dans le corrigé de l'exo, la bonne relation est : 1/188*1/50 = 1.1*10-4 mol.L-1.s-1
Je suppose que le "188" en question est le point de la courbe donnant l'absorbance à t = 50 s (oui ?)
Mais sur le graphe l'absorbance est donnée par 1 ; 2 ; 3 . Alors pourquoi 188 ici ? j'aurais plutôt dis 1.8...
A bon entendeur, merci à tous 
Bonjour, c'est un peu le bazar ton topic.
Le meilleure façon de procéder est de poster intégralement l'énoncé de l'exercice afin que le membre du forum se mette en tête le sujet de l'exercice, de poster les réponses aux questions faites (cela permet d'aller plus vite) et de poser ses questions sur telle question, telle méthode etc...
Très bien, bon :
Méthode physique : Spectrophotométrie
On étudie la cinétique de la réaction de décomposition de l'eau oxygénée H2O2 par les ions iodues I- en présence d'acide sulfurique.
Equation : H2O2 +2H3O+ +2I- -> 4H2O +I2
Conditions expérimentales :
on place dans la cuve de mesure du spectrophotomètre une volume V0 = 1.0 mL de solution d'eau oxygénée de concentration C = 0.080 mol.L-1
A t=0, on ajoute un volume V'0= 1.0 mL de solution acidifiée d'iodure de potassium de concentration C = 0.060 mol.L-1 - pourquoi acidifier la solution ?
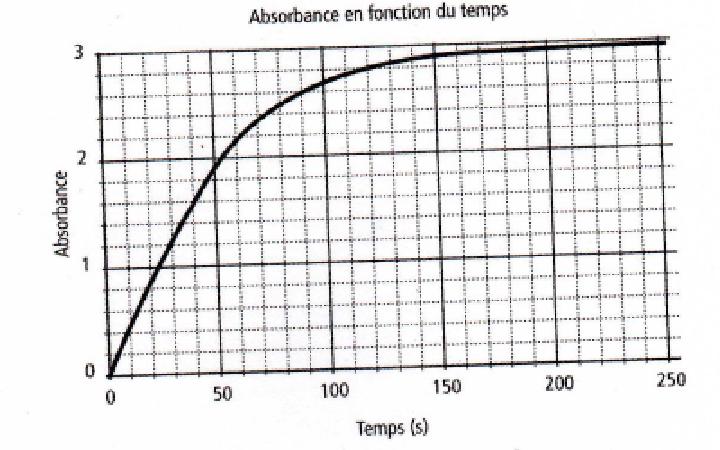
On lance la mesure de l'absorbance en fonction du temps (écarts entre mesures : 1s) on obtient le graphe ci dessous :
a) Exprimer la vitesse de réaction à un instant t en fonction de l'absorbance
Alors, la vitesse de réaction est : 1/V * dx/dt = 1/V * dnI2/dt = d[I2]/dt car V est constant, d'où v = 1/k *dA/dt - Ici, pourquoi diviser la dérivée de l'absorbance par rapport au temps par la constante k (qui vient de A = k.C ?)
b) Déterminer graphiquement la vitesse instantanée de formation de diiode à t=50s
Le coefficient directeur de la tangente à la courbe A = f(t) à t=50s est : (2.6-1.6)/(80-30) = 1/50s d'où v = 1/188*1/50 = 1.1*10-4 mol.L-1.s-1 - Ici, le coefficient de la tangente c'est ok, maintenant, que représente "1/188" ? d'où vient la valeur 188 ? j'ai cherché sur le graphe, j'ai vu que le point de la tangente à la courbe A = f(t) à t=50s serait 1.8 (entre 1 et 2) j'ai essayé de faire le lien mais je n'ai rien trouvé de ce coté là, je bloque ici