Inscription / Connexion Nouveau Sujet
Vitesse d'une réaction chimique
BONJOUR TOUT LE MONDE !
J'ai cet exercice à faire des en chimie pour étudier le facteur cinétique de la durée d'une réaction. J'ai deja faut la première question mais je ne comprends vraiment pas la suite, pourriez vous m'aider ? Merci énormément.
On souhaite synthétiser le 2-méthylpropan-2-ol par hydrolyse du 2-chloro-2-méthylpropane dans un solvant eau/éthanol.
Le 2-méthylpropan-2-ol est un alcool tertiaire de formule brute CH1oO. Sous pression atmosphérique, à température supérieure à 24,3 °C, c'est un liquide incolore très soluble dans l'eau et infiniment soluble dans l'éthanol et l'éther.
Le méthylpropan-2-ol est utilisé comme solvant pour les peintures, dans les carburants pour augmenter l'indice d'octane, ou comme intermédiaire dans la synthèse d'autres produits chimiques communs comme les parfums
La réaction étudiée est lente et totale:
R-Cl + 2H2O —> R-OH + H3O+ + Cl-
Lors d'une synthèse plusieurs paramètres sont à prendre en compte : les conditions opératoires, le rendement de la synthèse, la pureté du produit, la durée totale de la réaction.. Ces paramètres permettent d'établir le coût de la production.
On s'intéresse à la durée. En effet, plus cette durée est importante et plus le coût de production sera élevé. Le chimiste doit donc choisir les conditions optimales en terme de vitesse de réaction.
1. Ecrire les formules semi-développées du 2-méthylpropan-2-ol et du 2-chloro-2- méthylpropane La conductimétrie est adaptée pour suivre l'évolution temporelle de cette transformation.
2. Comment va évoluer la conductivité a au cours de la transformation ? Argumenter.
Document 1
Matériel et solutions disponibles
Solution alcoolique de 2 - chloro - 2 - méthylpropane à 10 % en volume ( on verse 50,0 mL de 2-chloro-2-méthylpropane dans une fiole jaugée de 500,0 mL et on complète jusqu'au trait de jauge avec de l'éthanol)
Eau distillée et éthanol
Conductimètre avec sa sonde
Agitateur magnétique
Logiciel d'acquisition (durée 15min et 30 points)
Document 2:
Protocole expérimental 1:
Introduire dans un grand bécher un volume V-100mL d'eau distillée. Immerger dans le bécher la sonde de conductimétrie.
Ajouter V- 5,0ml de la solution alcoolique de 2-chloro-2-méthylpropane et lancer simultanément l'acquisition
Agiter pendant 30 s uniquement
Document 2bis:
Protocole expérimental 2:
Introduire dans un grand bécher un volume V=70mL d'eau distillée et un volume V=30ml d'éthanol.
Immerger dans le bécher la sonde de conductimétrie.
Ajouter V=5,0ml de la solution alcoolique de 2-chloro-2-méthylpropane et lancer simultanément l'acquisition.
Agiter pendant 30 s uniquement.
Document 3:
Données physico-chimiques sur le 2-chloro-2-méthylpropane .
masse volumique p 0,85 g.ml
masse molaire moléculaire M-92,5 g.mol
miscible à l'éthanol en toutes proportions
solubilité très faible dans l'eau
1. La transformation étant totale, déterminer la valeur de l'avancement final x
2. Montrer que l'avancement au cours du temps est donné par la relation: x(t)=(n0*delta(t))/delta(f) avec: delta(f) la conductivité finale, delta(t) la conductivité au cours du temps, n0 la quantité de matière initiale de 2-chloro-2-méthylpropane introduite dans le bécher.
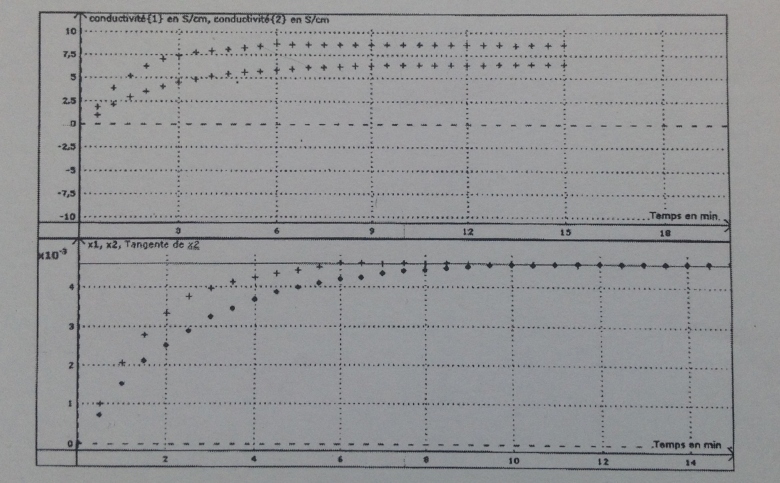
1. Déterminer pour chaque courbe le temps de demi-réaction. Argumenter.
2. Le solvant a t il une influence sur l'évolution de la transformation ? Argumenter.
Remarque: les courbes de la conductivité en fonction du temps n'atteignent pas le même état final delta(f) car les conductivités molaires des ions dépendent du solvant.
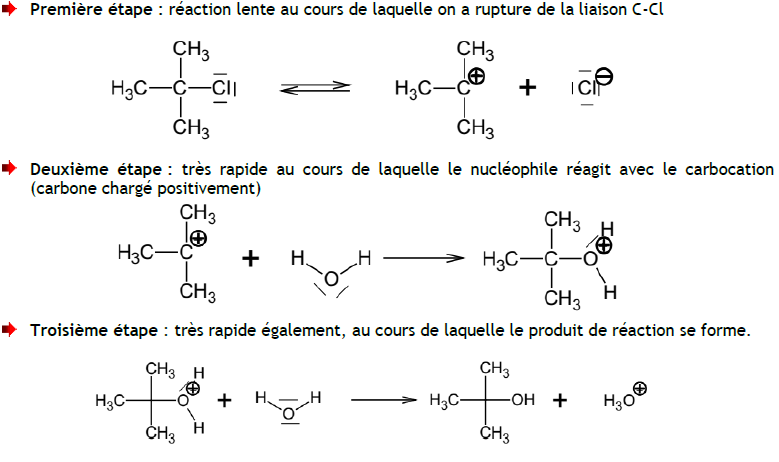
Bonsoir,
Cela fait beaucoup trop longtemps que j'ai fait de la chimie organique pour t'expliquer, mais j'ai trouvé ceci (à voir si cela correspond à ton besoin) :

2. Comment va évoluer la conductivité a au cours de la transformation ? Argumenter.
La réaction de synthèse du méthylpropan2-ol produit des ions donc .....
1. La transformation étant totale, déterminer la valeur de l'avancement final x
Avec les données de l'énoncé on calcule la quantité de matière initiale en 2-chloro-2-méthylpropane.
Ensuite à l'aide d'un tableau d'avancement on calcule la valeur de l'avancement final.
Merci pour vos réponses
J'ai trouvé 4,6.10-4mol pour l'avancement maximal et j'ai également fait mon tableau d'avancement. Mais je n'arrive pas à montrer la relation de la question 2. Pourriez vous m'expliquer ou m´aider ? Merci.
En ce qui me concerne, j'ai trouvé xfin = 4,6.10-3 mol
Bien entendu, je ne suis pas à l'abri d'une erreur de calcul, mais j'observe que sur le document qui donne les variations de x en fonction du temps, c'est bien la valeur de 4,6.10-3 qui correspond à x final
Je suggère que tu publies le détail de ton calcul pour pouvoir situer la cause de la différence observée entre nos résultats.
Il ne s'agit pas d'une simple erreur de calcul mais d'une mauvaise analyse du problème.
a) On a préparé la solution alcoolique à partir de 50mL de soluté de masse volumique 0,85 g/mL donc à partir de 50 * 0,85 = 42,5g de 2-chloro-2-méthylpropane.
b) Ces 42,5g ont ensuite été introduits dans un volume de 500mL (soit 0,5L) de solution. La solution ainsi obtenue a une concentration massique de 42,5 / 0,5 = 85 g/L et une concentration molaire
de 85 / 92,5 = 0,919 mol/l
c) On prélève ensuite 5,0mL de cette solution ce qui représente une quantité de matière n0 de
0,919 * 5.10-3 = 4,6.10-3 mol
d) Le tableau d'avancement (que tu n'as pas publié) montre que xfinal = n0
Donc xfinal = 4,6.10-3 mol
Question 2 :
Pour t'aider à faire cette question (sans pour autant la faire à ta place) j'ai besoin du tableau d'avancement. Merci de le publier.



