Inscription / Connexion Nouveau Sujet
Tp chimie manqué
Bonjour a tous
hier ma classe a fait un TP sur la determination d'une concentration par suivie conductimetrique.
ayant été malade hier, on ma communiqué la feuille, j'i pu repondre
au questions dite preliminaire mais jai un peu du mal a faire la seconde partie : suivi conductimetrique de la reacion en fonction du volume de solution de soude ajoutée. cest un peu dur de refaire un tp chez soi quand on a pas manipulé.
les données:
remplir la burette avec une solution de soude de concentration:
placer dans une grand becher une prise d'essai Vo= 20 mL d'une solution aqueuse So d'acide sulfamique de concentration inconnue Co.
introduire dans becher environ 150mL d'eau distillé.
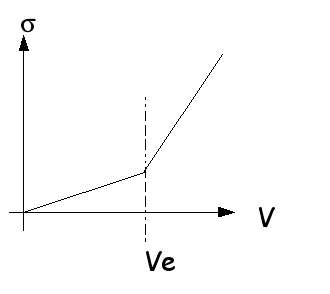
ce que je sais cest que lorsqu'il ont fait un graphique:
conductivité de la solution en fonction du volume Vb de la solution
d'hydroxyde de sodium versée; et bien la courbe decroit puis d'un seul coup elle se met a remonter, apparement quand la courbe etait bien faite sa formait une espece de courbe un peu comme la fonction valeur absolue...
Pouvez vous m'aidez svp ? merci d'avance.
1) interpretation de la premiere portion de courbe:
Comment varie la concentration des ions oxonium au debut de la reaction, justifier ?
elle diminue, mais apres je ne sais pas comment le justifier.
interpreter alors l'allure de la premiere partie de la courbe.
et bien sur la feuille on voit clairement que ca diminue mais comment interpreter ceci ?
qui est le reactif limitant a chaque ajout Vb dans cette premiere partie ?
je crois que cest les ions oxonium.
2) interpretation de la seconde portion de courbe:
interpreter le brusque changement de pente a partir d'un volume Ve ( a preciser) de solution de soude versé.
je sais que sa croit mais je ne sais pas comment interpreter ceci.
interpreter alors l'allure de la deuxiee partie de courbe ?
bah sa croit clairement sur le papier milimétré mais je ne sais pas comment l'interpreter.
qui est le reactif limitant lorsque Vb>Ve ?
la je n'en ai vraiment aucune idée...
Lorsque le volume de solution de soude versée est Ve on se trouve a l'equivalence.
dresser le tableau descriptif de la ransformation pour un volume de soude versée Vb=Ve.
mais avec quelle donnée ??
en deduire la concentration des ions oxonium presents initialement dans la prise d'essai.
Cest quoi la prise d'esai ?
En deduire la concentratio de la solution d'acide sulfamique ?
apparement la masse molaire de cette acde cest 97 g.mol-1
je sais que cest long jen suis desolé mais si vous pouvez m'aider un peu sa serait vraiment super.
Salut !
!
1) Quelle est l'équation de la solution? Quelles espèces apparaissent ou disparaissent? Quels sont les ions spectateurs?
2) Toutes les interprétations se font en répondant aux questions que je te posent...
en meme temps kaela, aurai pu tabstenir d eposter ca, cest tellement logique, cest de laide que je demande..
bonsoir krispolls
comme te le disais shadowmiko avant tout il faut trouver l'équation de la solution
il s'agit ici d'un dosage acido-basique suivi par conductimétrie
as-tu la formule de l'acide sulfamique dans ton TP ? sinon tu prends HA
couples mis en jeu : HA / A- et H2O / HO-
- écris l'équation de cette réaction
- trouve les ions spectateurs
oui jai tout ca cetais dans les questions preliminaires:
voila ce que j'ai trouvé:
NH2SO3H/NH2SO3 (avec un - au O)
H3O/H2O
NH2SO3H + H2O ---> NH2SO3 + H3O
lors du dosage tu ajoutes de la soude (NaOH) donc le deuxième couple est H2O / HO-
équation du dosage : NH2SO3H + HO-  NH2SO3- + H2O
NH2SO3- + H2O
ou encore H3O+ + HO-  2 H2O si on considère que l'acide sulfamique se décompose totalement dans l'eau selon l'équation que tu as écrite précédemment ce qui serait en accord avec les questions de ton TP
2 H2O si on considère que l'acide sulfamique se décompose totalement dans l'eau selon l'équation que tu as écrite précédemment ce qui serait en accord avec les questions de ton TP
les ions spectateurs sont les ions sodium Na+ apportés par la soude
1) [H3O+] diminue car les ions H3O+ réagissent avec les ions hydroxydes apportés par la soude
- la conductivité diminue car il y a de moins en moins d'ions H3O+
d'autre part les ions NH2SO3- formés et les ions Na+ accumulés devraient faire augmenter la conductivité mais ils ont une conductivité molaire ionique très faible par rapport aux ions oxonium
- le réactif limitant est l'ion hydroxyde (versé au fur et à mesure dans la solution)
es-tu d'accord avec cela ?
oui cette equation faisait partie d'une des question on a trouvé la meme chose: H3O+ + HO- --> 2 H2O
oui vu comme ça je comprend merci
2) le brusque changement de pente de la courbe est dü à une modification des ions présents en solution, c'est l'équivalence du dosage
- la conductivité augmente car la réaction est finie, toute la soude versée à partir de Ve s'accumule dans le bécher, il y a donc augmentation de la quantité d'ions donc de la conductivité.
- le réactif limitant lorsque Vb>Ve est donc l'acide sulfamique
dresser le tableau descriptif de la transformation pour un volume de soude versée Vb=Ve.
pour l'acide Vo= 20 mL, Co est inconnu (tu laisses Co dans le tableau)
pour la soude Vb = Ve (lu sur la courbe) et la concentration doit être donnée dans l'énoncé mais tu as oublié de la copier ici
a l'équivalence : les réactifs sont introduits dans les proportions stoechiométriques donc à l'état final n(H3O+) = n(HO-) = 0 mol
la prise d'essai c'est les 20mL d'acide que tu as introduit dans le bécher pour les doser
voici quelques indications pour la suite
| H3O+ + | HO-  | H2O | |
| état initial | CoVo | CbVe | excès |
| état intermédiaire | CoVo-x | CbVe-x | excès |
| état final | CoVo-xmax = 0 | CbVe-xmax = 0 | excès |
tu connais Cb et Ve donc à partir de CbVe-xmax = 0 tu peux trouver xmax
en reportant xmax dans CoVo-xmax = 0 (connaissant Vo) tu trouves Co
excuse moi cp jetais parti manger.
daccrd je dois faire ensuite les calculs mais par contre
dans la colone exces, cets pas plutot 2H2O ?
donc cela va donner
1ere colonne:
Co.20
Co.20-x
Co.20-xmax = 0
par contre pour la deuxime colone je n'ai pas tout saisi
donc ca va etre la concentration de la soude (Cb) multiplier par Ve
vous avez dit plus haut que Vb=Ve mais le truc cest que je connais aucun des
deux, je dois trouver ces valeur sur le graphique ?
Ve est le volume de soude (Vb) versé à l'équivalence donc quand la courbe change de pente : tu le lis en effet sur la courbe
attention le volume de la prise d'essai est 20 mL donc il est conseillé de le convertir en L (de même que le volume Ve)
Rq : sur le forum tu peux me tutoyer
ah oui daccord je comprends, en gros cest le point le plus bas, le minimum sur la courbe, si on veut utiliser un language mathematique^^
ps: daccord sa marche merci beaucoup pour tout , passer un bon debut de semaine !
oui c'est le minimum de la courbe dans ton cas
mais ce ne sera pas toujours le minimum. ex : dosage du vinaigre par la soude
Le volume équivalent correspond toujours au changement de pente.