Inscription / Connexion Nouveau Sujet
Titrage indirect
Bonsoir, pourriez-vous m'aider à finir cet exercice?  Le voici :
Le voici :
Manipulation
L'acide ascorbique de formule C6H8O6 est un réducteur appartenant au couple C6H6O6/C6H8O6. On va le titrer par un titrage en retour: on ajoute du diiode (oxydant appartenant au couple I2/I- en quantité connue et en excès. On titre ensuite l'excès de diiode restant grâce à une solution de thiosulfate de sodium (S4O62-/S2O3-2).
On a préparé une solution S0 en dissolvant un comprimé du médicament contenant d'après l'étiquette 500mg de vitamine C dans 200mL d'eau distillée.
a)Préparer par dilution de S0 une solution S1 de concentration dix fois plus faible. Soit c1 cette concentration pour l'instant inconnue.
b)Prelever V1=20,0mL de S1 et l'introduire dans un erlenmeyer.
c)Y ajouter V2=20,0mL de solution de diiode de concentration c2.
4)Préparer la burette graduée avec la solution titrante de thiosulfate à c3=0,0100 mol/L.
5)Réaliser le dosage (quelques gouttes d'empois d'amidon à l'équivalence pour bien reperer). Noter le volume VE. J'ai trouvé VE=15,1mL (un mL de trop à mon avis mais bon on fera avec)
La concentration théorique de la solution de diiode est de 5,00.10-3mol/L mais peut avoir ici une concentration un peu differente de par la manière dont elle a été fabriquée. On réalise donc un titrage de cette solution en utilisant la solution de thiosulfate de sodium comme sol titrante. On titre V3=10,00mL de sol de diiode. Ce la sert à vérifier c2. Je trouve un volume équivalent Véq=9,7 mL.
Exploitation
1)Ecrire l'équation de la réaction qui a lieu entre le diiode et l'acide ascorbique.
2)Ecrire l'équation de la réaction de titrage entre le diiode et les ions thiosulfate.
3)En détaillant les raisonnements, déterminer la masse de vitamine C dans un sachet, commenter.
_________________
1)I2+C6H8O6=2I-+C6H6O6 + 2H+ (tout en aq)
2)2S2O32- +I2=S4O62-+2I-
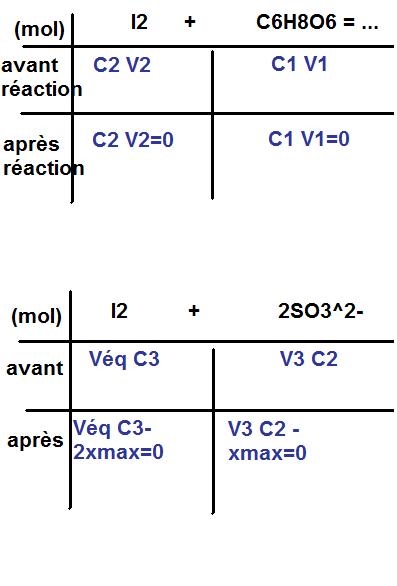
3)J'ai trouvé les relations
C2V2=C1V1 et C2V3=VéqC3/2 d'après les tableaux suivants:
est ce juste? comment continuer?
Merci d'avance
le premier dosage permet de doser la qté de I2 restante,c'est à dire celle qui n'a pas réagi
le deuxième dosage est indépendant:il ne sert qu'à contrôler la concentration C2. (C'est cette valeur expérimentale qui sera utilisée)
principe du dosage par différence
on utilise une qté connue de I2 en excès
soit n(I2)i cette qté de matière
n(I2)i= C2*V2
une partie de I2 réagit avec l'acide ascorbique .
soit n(I2)asc cette qté de matière
on dose avec le thiosulfate la qté de I2 restante
soit n(I2)r cette qté de matière
la qté de matière de I2 qui a réagi avec l'acide ascorbique est
n(I2)asc=n(I2)i - n(I2)r
il faut donc établir une relation entre n(I2)r et n(S2O3-2
n(I2)r-xmax=0 et n(S2O32-)-2xmax=0 à l'équivalence du premier dosage
on a donc n(I2)r= n(S2O32-)/2 =C3*Veq (1)/2
on peut donc calculer n(I2)asc par différence.
le premier tableau ne convient pas
En fait il faut 3 tableaux
un tableau d'avancemnent de la réaction n(I2)asc avec l'acide ascorbique
un tableau d'avancement du dosage de n(I2)r parS2O32-
un tableau d'avancement de n(I2)( C2,V3 ) par S2O3 (C3,Veq(2) ) pour contrôle de la concentration C2.
sauf étourderie...
Quand tu écris Véq(1) c'est VE et Véq(2) c'est Véq?
Pour la vérification de c2 je rencontre un problème, on a l'égalité
C2=Véq*C3/2*V3=9,7.10^-3*0,0100/2*10,0.10^-3 = 4,85.10^-7 mol/L ce qui est loin de 5,00.10^-3 mol/L !  que faire?
que faire?
Je ne comprends pas pourquoi I2 réagit avec S2O3 un coup et S2O3^2- l'autre fois, peux tu m'expliquer?
Tu dis qu'on a n(I2)i mais où?
merci
il y a deux problèmes indépendants
---réaction de I2 avec l'acide ascorbique
---détermination expérimentale de la concentration (C2 )de I2 .Elle doit être voisine de 5.10-3mol/L.
commençons par cette vérification de C2
A 'léquivalence
n(I2)=n(S2O32-)/2
cette relation se retrouve avec un tableau d'avancement
C2*V3=C3*Veq/2
C2= (C3*Veq)/(2*V3)
C2=(0,01*9,7)/(2*10)
C2=4,85.10-3mol/L au lieu de 5.10-3mol/L
etude de la réaction de I2 avec l'acide ascorbique
puisque C2 est maintenant connu ,on peut calculer n(I2)initial
n(i2)i=C2*V2=4,85.10-3*20,0.10-3
n(I2)i=9,5.10-5mol
maintenant tu peux te reporter à mon post précédent
Je regarde ça et je te pose mes questions si incompréhension mais qu'est ce que mon premier tableau avait de faux?

C2*V2 est la qté de matière initiale de diiode .Or ,seule une partie de ce diiode réagit avec l'acide ascorbique.
Donc ,la qté de matière d'acide ascorbique C1*V1 ne réagit pas avec la qté C2*V2 mais avec une qté de I2 inférieure.
Cette qté de I2 se trouve par différence
n(I2) réagissant avec l'acide= n(I2)initiale -n(i2) restant
n(I2) restant est déterminée par dosage avec le thiosulfate


