Inscription / Connexion Nouveau Sujet
Titrage et diarrhée.
Bonsoir, j'ai lu attentivement les règles pour poster sur ce forum et il y a bien écrit qu'il faut toujours écrire le sujet et non le scanner.
Mais j'ai besoin d'aide pour un exercice de chimie de première S et le sujet me semble bien long et bien chargé c'est pourquoi je me suis permise de le mettre tel qu'il est. Bien sûr je m'en excuse d'avance.
J'ai essayé de commencer à faire certaines choses mais j'ai des blocages à certains questions ...
1. Ag+(aq)+Cl-(aq) AgCl (s)
2. La réaction doit être totale, c'est à dire que les réactifs doivent être totalement consommées, rapide et non perturbée par une autre réaction ayant les mêmes réactifs mais des produits différents.
3. fiole jaugée de 200 mL
4. pipette jaugée de 20 mL
5. Je ne sais pas :s
6. Lors d'un titrage, l'équivalence est l'état final du système chimique pour lequel le réactif titré devient le réactif limitant.
C'est tout ce que j'ai réussi à faire pour le moment, c'est pourquoi j'aurai besoin d'aide.
Merci d'avance !
** image de l'énoncé scanné effacée **
** image de l'énoncé scanné effacée **
Edit Coll : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
![]()
Voici l'énoncé :
La diarrhée entraîne une perte d'eau. Il faut empêcher cette perte hydrique par des apports de liquides. L'eau pure ne suffit pas. En effet, la déshydratation est le résultat non seulement d'une perte en eau mais aussi en électrolytes (sels minéraux: sodium, potassium, chlorure, bicarbonates etc.).
Pour réhydrater un nourrisson, il faut donc apporter non seulement de l'eau mais aussi des électrolytes. L'eau et les électrolytes vont empêcher la déshydratation mais ne nourrissent pas l'enfant.
L'Adiaril® est une préparation de régime pour réhydrater les enfants en cas de diarrhée. On dilue chaque sachet de 7g dans l'eau pour obtenir 200 mL de solution.
Composition de l'Adiaril (extrait du tableau figurant sur la boîte) : pour un sachet de 7g (soit 200 mL de solution ) :
| Glucose | Saccharose | Sodium | Potassium | Chlorure | Citrate | Gluconate |
| 2.65 g | 2.49 g | 0.274 g | 0.156 g | 0.210 g | 0.376 g | 0.778 g |
Mise en évidence de la réaction support du titrage : dans un tube à essais A contenant V1 = 2 mL de solution aqueuse de chlorure de sodium (Na+ + Cl-) de concentration c1 = 5.10-2 mol/L, on ajoute V=2mL de solution de nitrate d'argent (Ag+ + No3-) de concentration c = 4,25.10-2 mol/L et on observe la formation d'un précipité blanc de chlorure d'argent.
1. Écrire l'équation de la seule réaction ayant lieu dans le tube à essais A.
2. Quelles doivent être les propriétés de cette réaction pour qu'elle soit utilisée dans ce dosage ?
On se propose de vérifier la masse d'ions chlorure dans un sachet.
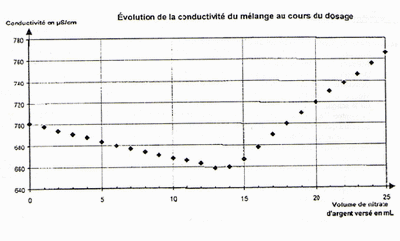
Pour cela on décide de réaliser un titrage par conductimétrie. On dissout un sachet d'Adiaril® dans V = 200 mL d'eau. On prélève V2 = 20,0 mL de cette solution (S) que l'on place dans un bécher et on ajoute 200 mL d'eau distillée. On plonge dans le milieu une cellule de conductimétrie et on mesure la conductivité du mélange après chaque ajout de solution de nitrate d'argent de concentration C = 4,25.10-2 mol/L. On obtient le graphe que j'ai joint.
3. A propos du protocole : quelle verrerie utiliseriez-vous pour préparer la solution de 200mL d'Adiaril ?
4. Quelle verrerie utiliseriez-vous pour prélever V2 = 20,0 mL de solution ?
On donne les conductivités ioniques molaires des ions présents dans la solution d'Adiaril :
| sodium | potassium | chlorure | citrate | gluconate | argent | nitrate | |
| Na+ | K+ | Cl- | Ci3+ | gluc- | Ag+ | No3- | |
| mS.m².mol-1 | 5.01 | 7.35 | 7.63 | 21 | 1.5 | 6.19 | 7.14 |
5. Donner les raisons qui conduisent à prélever une grade quantités de solution à titrer (ici 200 mL) pour effectuer le titrage.
6. Donner une définition de l'équivalence.
7. Expliquer pourquoi avant l'équivalence la conductivité du mélange décroit.
8. Expliquer pourquoi après l'équivalence la conductivité du mélange croit.
9. Pourquoi l'augmentation après l'équivalence est-elle plus rapide que la diminution avant l'équivalence ?
10. Déterminer sur le graphe, le volume de la solution nitrate d'argent versé à l'équivalence.
11. En déduire la concentration des ions chlorure présents dans la solution (S).
12. En déduire la masse mexp d'ions chlorure dans le sachet.
13. Comparer votre résultat à celui lu sur l'étiquette en calculant l'erreur relative (pourcentage d'erreur).
Mes réponses :
1. Ag+(aq)+Cl-(aq) AgCl(s)
2. La réaction doit être totale, c'est à dire que les réactifs doivent être totalement consommées, rapide et non perturbée par une autre réaction ayant les mêmes réactifs mais des produits différents.
3. fiole jaugée de 200 mL
4. pipette jaugée de 20 mL
5. Ajouter une grande quantité d'eau permet de pouvoir négliger la dilution et la conductivité d'une solution n'est proportionnelle à sa concentration que si la solution est diluée c'est à dire pour une concentration inférieure 10-2 mol/L.
6. Lors d'un titrage, l'équivalence est l'état final du système chimique pour lequel le réactif titré devient le réactif limitant.
7. 7. Avant l'équivalence la conductivité du mélange décroit car au fur et à mesure du titrage, les ions Cl- sont remplacés en quantité égale par des ions NO3-, de conductivité molaire plus faible.
8. Après l'équivalence la conductivité du mélange croit car au fur et à mesure du titrage, des ions Ag+ et des ions NO3- sont ajoutés.


