Inscription / Connexion Nouveau Sujet
titrage
Bonjour à tous j'ai un ds la semaine prochaine sur la chimie (titrage, acide base...) et j'aimerais réussir cet exercice pour m'entrainer :
Etudions le titrage d'un volume Va=10ml d'acide éthanoique CH3COOH de concentration Ca inconnue mais voisine de 0,1mol/L par de la soude de concentration Cb=0,1mol/L.
a) Ecrire la réaction de dosage.
b) Commenter le graphique obtenu.
c) Déterminer le volume de soude versée à l'équivalence et calculer Ca.
d) Déterminer le pH de la solution initiale, celui de la solution à la demi équivalence puis celui de la solution à l'équivalence.
j'ai fait :
a) CH3C00H + HO- = CH3C00- + H20
b)On remarque un saut de pH.
c) Veq=10ml donc CaVA=CBVeq d'où Ca= 0,1*10/10=0.1mol/L
d) pH initial = 3
Ph demi = 7 et l'autre je n'y arrive pas
merci de m'aider !
Bonjour,
Tes réponses sont corrects sauf pour la question d)
le pH initial est bien de 3
La demi-équivalence d'un dosage correspond à la situation où la moitié du volume vEq de réactif titrant a été versé et à la demi-équivalence, le pH est égal au pKA du couple AH/A
le pKa est affiché sur ton graphique et vaut environ 4,8
Enfin, pour trouver le Ph à l'équivalence il faut utiliser la méthode des tangentes, tu as du le voir en cours mais voici un exemple :
à vu d'oeil le pH doit être aux environs de 9
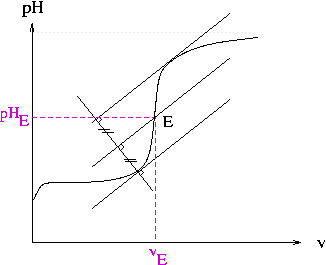
Le pH à la demi équivalence ne correspond pas à la moitié du pH équivalent.
à la demi équivalence on a [A] = [B] et on sait que pH = pKa + log ([A]/[B])
pH = pKa + log (1) log(1) = 0
pH = pKa


