Inscription / Connexion Nouveau Sujet
titrage
bonjour,
je ne sais pas comment interpréter qualitativement l'évolution de la conductivité (précisez en particuliez les espèces ioniques présentes avant et après l'équivalence)
je sais que les ions présents sont :
[CH3COOH]
[H2O]
[OH-]
[CH3COO-]
en cours on a juste dit que les quantités augmentent, ou diminuent ou restent constantes, ou sont nuls!
mais je n'ai pas compris comment faire!
pouvez m'aidez merci
L'acide acétique (ou éthanoïque) CH3COOH est un acide.
1. Quelle est sa base conjuguée ? Ecrire l'équation de la réaction de cet acide avec l'eau. On précisera les couples acide/base intervenant dans cette réaction.
2. Un vinaigre est une solution d'acide acétique. On prélève, à l'aide d'une pipette jaugée, 10 mL de vinaigre que l'on verse dans une fiole jaugée de 100 mL. On complète avec de l'eau distillée jusqu'au trait de jauge et on homogénéise. Soit S la solution obtenue. On appelle c et cS les concentrations en acide acétique du vinaigre et de la solution S. Quelle relation y a entre c et cS ?
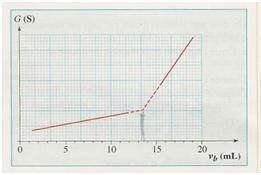
On réalise le dosage conductimétrique d'un volume vS de solution S par une solution d'hydroxyde de sodium (ou soude) de concentration Cb = 0,10 molS 1 Pour cette manipulation, on prélève 10 mL de la solution S, on y ajoute de l'eau distillée et on suit l'évolution de la conductance G de la solution S, en fonction du volume Vb de la solution d'hydroxyde de sodium versée.
3. Écrire l'équation de la réaction acido-basique entre l'acide acétique de la solution S et l'ion hydroxyde de la solution d'hydroxyde de sodium.
4. Construire le tableau permettant d'étudier la transformation en utilisant l'avancement x.
5. Définir l'équivalence. Quelle relation peut-on écrire à l'équivalence?
6. Interpréter qualitativement l'évolution de la conductivité (On précisera en particulier les espèces ioniques présentes avant et après l'équivalence).
voila c'est pour la question 6 que j'ai besoin d'aide!
1)la base conjuguée de CH3COOH est CH3COO- (l'ion éthanoate).
équation de la réaction de cet acide avec l'eau
CH3COOH+H2O = CH3COO- +H3O+
2)c.v=cs.vs
10c= 100cs => c =10 cs
3)CH3COOH+HO- ---> CH3COO- +H2O réaction totale.
4)CH3COOH + HO- ---> CH3COO- +H2O
csvs cb.vb 0 0
csvs-x cb.vb-x 0 0
5) équivalence =>n(CH3COOH)=n(HO-)
=> relation d'équivalence:
cs.vs = cb.vb
6)
au début du dosage la faible conductivité de la solution est due aux ions acétate CH3COO- en faible quantité car la dissociation de l'acide acétique ds l'eau est très faible.
ensuite lorsqu'on commence le dosage la conductivité de la sol augmente légérement au fure et à mesure que le volume de soude ajouté augmente . ceci est due à l'augmentation de la concentration des ions CH3COO- ds la sol . (ces ions sont produits par la réaction de dosage):
CH3COOH + HO- ---> CH3COO- +H2O
chaque fois qu'un ion HO- est ajouté il réagit avec une molécule d'acide pour former un ion acétate.
le pic correspond au point d'équivalence ds lequel brusquement toutes le molécules d'acide CH3COOH ont disparu.
Après l'équivalence les ions HO- ajouté ne trouve plus les molécules d'acide ,et restent ds la solution pour faire augmenter rapidement car la conductivité molaire ionique des ion HO- est importante par rapport à celle des ions acétates.
 (OH- )=19,86 mS.m2.mol-1
(OH- )=19,86 mS.m2.mol-1
 (CH3COO-)= 4,09 mS.m2.mol-1
(CH3COO-)= 4,09 mS.m2.mol-1
merci pour votre réponse, mais la réponse à la question 6 je n'arrive pas à la comprendre!
quelqu'un peut-il reformuler plus simplement?
en me disant les ions qui augmentent, ce qui diminuent, ce qui sont spectateurs, et le réactif limitant! avant et après l'équivalence.
merci
Malgrès que les ions sodium Na+ de la soude n'ont aucun caractère acido basique ,(inactifs),on ne peut pas dire que sont des ions spectateurs au point de vue conductivité , mais du fait que leur nombre de moles augmente aucours du dosage alors leur concentration aussi augmente par conséquence leur conductivité augmente .
bonsoir
Quelqu'un peut-il m'aider pour cette question
9. Le degré d'acidité d'un vinaigre est numériquement égal à la masse, en grammes, d'acide acétique pur contenu dans 100 g du vinaigre. La masse molaire moléculaire de l'acide acétique est égale à 60 g.mol-1. La masse volumique du vinaigre étudié est 1,0 g.mL-1. Calculer son degré d'acidité.
--> j'ai trouvé:
T=C*M = 0,0135*60= 0,81 g/L
m= (T*100)/masse volumique
m= 0,81*100/0,1 = 810g
donc 8,1% d'acidité!!
mais je ne suis pas sur au niveau des unités et des puissances!!
quelqu'un peut-il m'aider merci


