Inscription / Connexion Nouveau Sujet
Thermochimie enthalpie libre
Bonjour, j'ai fais un autre exercice pour m'entraîner ^^ pour lequel j'aurais besoin de votre approbation. Merci de votre temps pour m'aider à comprendre.
Ch4(g) + CO2(g) --> 2CO(g) + 2H2(g)
Données :
 fHT0 (CH4(g)) = -74,81 kJ/mol
fHT0 (CH4(g)) = -74,81 kJ/mol
 fHT0 (CO2(g)) = -393,505 kJ/mol
fHT0 (CO2(g)) = -393,505 kJ/mol
 fHT0 (CO(g)) = -110,541 kJ/mol
fHT0 (CO(g)) = -110,541 kJ/mol
 fHT0 (H2(g)) = 0 kJ/mol
fHT0 (H2(g)) = 0 kJ/mol
ST00 (CH4(g)) = 186,26 J/K/mol
ST00 (CO2(g)) = 213,77 J/K/mol
ST00 (CO(g)) = 199,66 J/K/mol
ST00 (H2(g)) = 130,68 J/K/mol
1. Calculer  rH0298 et
rH0298 et  rS0298.
rS0298.
 rH0298 = -1 x -74,81 - 393,55 + 2x-210,541+2x0 = 47,278 kJ/mol
rH0298 = -1 x -74,81 - 393,55 + 2x-210,541+2x0 = 47,278 kJ/mol
 rS0298 = -1x186,26-213,77 + 2x199,66 + 2x130,68 = 260,25 J/K/mol
rS0298 = -1x186,26-213,77 + 2x199,66 + 2x130,68 = 260,25 J/K/mol
2. On porte à 1000 K et sous p= 1 bar un mélange renfermant 0,1 mole de chacun des constituants. Si la pression et la température restent constantes, étudier l'évolution du système. On admettra que  rH0298 =
rH0298 =  rH01000 et
rH01000 et  rS0298 =
rS0298 = rS01000
rS01000
 rG01000 =
rG01000 =  rH0298 - T
rH0298 - T rS0298 = -212972 J/mol
rS0298 = -212972 J/mol
 rG< 0 alors d
rG< 0 alors d > 0, la réaction évolution de gauche à droite, formation de C0 et H2
> 0, la réaction évolution de gauche à droite, formation de C0 et H2
Je n'ai pas pris le temps encore de vérifier tes calculs mais a priori : tu confonds l'enthalpie libre standard de réaction qui, pour une réaction donnée, ne dépend que de la température, avec l'enthalpie libre de réaction
qui dépend de
mais aussi du quotient de réaction...
Selon mes calculs :
La constante d'équilibre K à 1000K vérifie :
L'enthalpie libre de réaction du système vérifie :
où Qr est le quotient de réaction. Dans le cas d'un mélange de gaz assimilables à des gaz parfaits comme ici :
Les quatre quantités de gaz étant égale à l'instant initial, chaque pression partielle vaut P°/4. Le quotient initial vaut :
L'enthalpie libre de réaction vaut à l'instant initial :
Cette valeur est strictement négative. Le système est chimiquement instable et va évoluer spontanément dans le sens direct. On peut aussi écrire :
L'équilibre sera atteint pour soit pour un quotient de réaction égal à la constante d'équilibre :
.
Il te reste à remplir un tableau d'avancement pour trouver la composition finale du système à l'équilibre... Ce n'est pas parce que, dans le cas particulier de l'équilibre, constante d'équilibre et quotient de réaction ont même valeur qu'il faut confondre les deux notions...
Pourquoi avons nous le droit de dire que
 rG = R.T
rG = R.T  ln (Qr/K)
ln (Qr/K)
C'est surtout ce qui y a en rouge qui m'intrigue. Concernant le tableau d'avancement il me permet de trouver les pressions partiels de chacun des composants c'est bien ça.

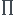 (pi/p0)vi)
(pi/p0)vi)
