Inscription / Connexion Nouveau Sujet
Accueil l'île de la physique - chimie Forum de physique - chimieListe de tous les forums de physique - chimie SupérieurOn parle exclusivement de physique/chimie, pour le supérieur principalement, les BTS, IUT, prépas... Maths supForum Supérieur de maths sup ChimieTopics traitant de Chimie [tout]Lister tous les topics de physique - chimie
Niveau maths sup
Taux d'avancement à l'équilibre
Posté par Mathilde17
Bonjour à tous,
J'aurais besoin d'aide pour terminer l'exercice suivant.
Citation :
Cet exercice vise à étudier le procédé Deacon, une méthode industrielle de fabrication du dichlore par oxydation catalytique du chlorure d'hydrogène par le dioxygène suivant l'équation suivante:
} + O_2_{(g)} = 2H_20_{(g)} + 2Cl_2_{(g)})
Le mélange gazeux en entrée du réacteur contient du chlorure d'hydrogène et de dioxygène pur, dont le rapport molaire initial est:
Données: à et sous une pression de
et sous une pression de 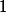 bar, la constante d'équilibre vaut
bar, la constante d'équilibre vaut  .
.
1) Calculer la valeur du taux d'avancement du chlorure d'hydrogène à l'équilibre, noté
2) Trouver la composition du gaz en sortie de réacteur
3) Déduire des questions précédentes la suite du procédé
Cet exercice vise à étudier le procédé Deacon, une méthode industrielle de fabrication du dichlore par oxydation catalytique du chlorure d'hydrogène par le dioxygène suivant l'équation suivante:
Le mélange gazeux en entrée du réacteur contient du chlorure d'hydrogène et de dioxygène pur, dont le rapport molaire initial est:
Données: à
1) Calculer la valeur du taux d'avancement du chlorure d'hydrogène à l'équilibre, noté
2) Trouver la composition du gaz en sortie de réacteur
3) Déduire des questions précédentes la suite du procédé
J'ai utilisé pour la première question la définition du quotient réactionnel, et après avoir mené le calcul analytique jusqu'où je pouvais, j'ai utilisé un tableur pour trouver
Je bloque pour la suite...
Merci d'avance pour votre aide!


