Inscription / Connexion Nouveau Sujet
Synthèse du trioxyde de soufre
Bonjour à tous,
Pouvez vous me corriger mon exo, ainsi que m´aider à le complèter?
Le trioxyde de soufre, de formule SO3, est utilisé pour préparer l´acide sulfurique. On l´obtient en faisant réagir du dioxygène de soufre (SO2) sur du dioxygène.
On dispose de 300L de dioxygène et de 10mol de dioxygène de soufre. On désire connaître le réactif limitant et la masse de trioxyde que l´on peut obtenir. (Masse molaire: S=32,0g/mol ; O=16,0g/mol)
1) De quelle quantité de trioxyde dispose t on? (Le volume molaire dans les conditions de l´expérience est de 24L/mol)
---------1/24=x/300
---------D´où x=300/24=12,5
---------Dans 300L de dioxygène, nous disposons de 12,5mol.
2) Écrire l´équation chimique de cette transformation de synthèse du trioxyde de soufre
---------2SO2+O2=2SO3
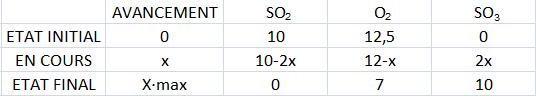
3) Construire un tableau de quantité de matière des espèces chimiques et faisant apparaître l´avancement x.
---------table à la fin du devoir 
4) Quel est le réactif limitant? Justifier la réponse.
---------Le réactif limitant et l´avancement maximal sont déterminés en calculant la valeur de X qui annule la
---------quantité de chaque réactif, la plus petite valeur de X trouvée nous donne le réactif limitant puisque
---------celui-ci disparaît en totalité. Ainsi, le réactif limitant est SO2, puisqu´il disparaît
---------complètement.
5)Quelle masse de trioxyde de soufre peut - on obtenir?
(là, je plafonne, aucune idée de ce qu´il faut faire... pouvez vous m´aider sur cette question)
pouvez vous m´aider sur cette question)
Merci à tous!
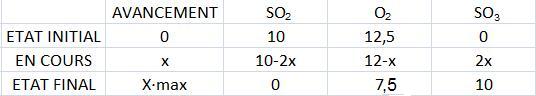
Ne t'es pas trompé dans la question 1) ??
dois-tu chercher la quantite de O2 ou la quantité de SO3 ?
tu dis que nous disposons de 300 L d'O2 donc nous disposons de 12.5 mol d'O2 (et non de SO3)
que tu vas faire réagir avec 10 mol de SO2
or il faut 2 moles de SO2 pour 1 mole d'O2, donc c'est bien le SO2 qui est le produit limitant (l'O2 est en excès)
tu vas donc produire 10 moles de SO3
la masse molaire du SO3 = 80 g/mol
donc masse de SO3 produite = 10 x 80 = 800 g
oui le reste est bien:
10 moles de SO2 réagissent avec 5 moles d'Os pour former 10 moles de SO3, et il reste 5 moles d'O2
Bonjour,
Th29, vous pouvez m'expliquer votre raisonnement pour r il faut 2 moles de SO2 pour 1 mole d'O2, donc c'est bien le SO2 qui est le produit limitant (l'O2 est en excès)
r il faut 2 moles de SO2 pour 1 mole d'O2, donc c'est bien le SO2 qui est le produit limitant (l'O2 est en excès)
tu vas donc produire 10 moles de SO3
la masse molaire du SO3 = 80 g/mol
donc masse de SO3 produite = 10 x 80 = 800 g
Je comprend pas où vient le 80g? et pourquoi on va produire 10 moles de S03?
Merci de me répondre, svp
J'aime pas recopier quand j'ai pas compris, ça serai gentil si quelqu'un pourrait m'expliquer ce raisonnement:
il faut 2 moles de SO2 pour 1 mole d'O2, donc c'est bien le SO2 qui est le produit limitant (l'O2 est en excès)
tu vas donc produire 10 moles de SO3
la masse molaire du SO3 = 80 g/mol
donc masse de SO3 produite = 10 x 80 = 800 g
Je vous en serai reconnaissante, merci...
Je suis désespérée, je sais vous devait pas avoir vraiment de temps mais je demande pas grand chose, je voudrai juste comprendre... J'espere que quelqu'un pourra m'aider.
Salut ps3udO,
C'est le raisonnement de Th29 que je ne comprend pas, peut-tu me l'expliquer stp?
il faut 2 moles de SO2 pour 1 mole d'O2, donc c'est bien le SO2 qui est le produit limitant (l'O2 est en excès)
tu vas donc produire 10 moles de SO3
la masse molaire du SO3 = 80 g/mol
donc masse de SO3 produite = 10 x 80 = 800 g
Tu connais bien la formule n = m / M ?
donc m = n * M
m= masse molaire du SO3 c'est à dire 32+16*3=80g.mol-1 muplitiplié par les 10 mol maximum que tu peux produire.
N'hésite pas à retourner voir ton cours des chapitres précédents quand tu es perdue , c'est ce que j'ai fais ^^
J'espère t'avoir un peu éclairée...