Inscription / Connexion Nouveau Sujet
Suivi d'une reaction
Bonjour, je n'arrive pas a faire ce sujet d'apres le bac de 2003. Pouvez vous m'aider? Voici l'enoncé:
On se propose d'étudier la transformation lente de décomposition de l'eau oxygénée par les ions iodure en présence d'acide sulfurique. L'équation de la reaction s'ecrit:
H2O1(aq) + 2I-(aq) + 2H3O+(aq)  I2(aq) + 4H2O(l)
I2(aq) + 4H2O(l)
A la date t=0 s on melange 20,0mL d'une solution acidifiée d'iodure de potassium, de concentration 0.10 mol/L, 8.0 mL et 2.0 mL d'eau oxygénée a 0.1 mol/L
1. Etablir le tableau descriptif de l'évolution du systeme. Les ions H3O+ sont en large exces
2. Etablir la relation entre [I2] et l'avancement x de la transformation. ([I2] = concentration molaire de I2)
3. Determiner l'avancement maximal. En deduire la valeur theorique de la concentration en diiode formé lorsque la transformation est terminée.
Merci beaucoup de votre aide et de votre temps!
Salut !
!
Es-tu réellement en première? Ton niveau indique même seconde...
Le pb est que tu dois utiliser des formules et des notions de chimie et de maths que l'on voit en terminale
Je comprends pas ce que tu veux dire?
Ouai mais en meme temps notre prof nous l'a donner, d'ou la demande d'aide lolz
ah... As-tu vu le mode de fonctionnement des enzymes en SVT (juste pour te donner une idée de la tête de la courbe)
Bon pas grave...
Considérons la réaction chimique dont l'équation est: aA + bB cC + dD où A et B sont les réactifs, C et D les produits et a, b, c et d sont les nombres stoéchiométriques.
Les notations utilisées dans la suite sont résumées ci-dessous:
x: avancement de la réaction
n(A)0: quantité de matière initiale de A
n(A): quantité de matière de A à la date t
n(A)f: quantité de matière finale de A
Il en est de même pour les autres espèces.
D'après un tableau d'avancement on a:
Par définition, la valeur commune x de ces rapports est appelée avancement de la réaction.
Considérons uniquement le cas particulier d'une réaction ayant lieu en solution aqueuse telle que le volume V de la solution soit constant.
avec [X]: concentration molaire (en mol.L-1)
n(X): quantité de matière de l'espèce X en solution (en mol)
V: volume de la solution (en L)
D'après ce qui précède, en divisant tous les termes de la relation de définition de l'avancement par V:
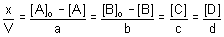
Ok, tu comprends?
faut j'y aille :S si tu pouvais me le faire et demain j'essaierais de comprendre comment ta fais car en vraie j'ai compris ni le 2 ni le 3 et le 1 j'vois pas comment faire :S
Re !
!
Tu fais un tableau d'avancement classique...
Tu as les concentrations et les volumes et n = C*V...
salut shadowmiko et Vannou
un petit complément si vous permetez.
1)
no(H2O2)=cv=10.10-3mL.0,1mol/L=10-3 mol
no(I- )=c'v'=20.10-3mL.0,1mol/L=2.10-3 mol/L
Tableau d'avancement:
H2O2 + 2I- + 2H3O+ = I2 + 4H2O
10-3 2.10-3 excès 0 0
10-3 -x 2.10-3 -2x excès x 4x
2)
3°)10-3 -xmax=0 => xmax=10-3 mol
2.10-3 -2x =0=> xmax=10-3 mol
cela montre que ces deux réactifs sont utilisés dans des proportions stochiométriques.
VS=30mL.


