Inscription / Connexion Nouveau Sujet
Suivi cinétique d'une réaction chimique par conductimétrie
Bonjour,
J'ai une préparation de TP à faire pour mardis et j'ai du mal à repondre aux questions, les notions remonte au début de l'année dernière et j'avoue que j'ai un peut tout oublier :s. Pourriez vous m'aider s'il vous plaît ?
Le 2-bromo-2-méthylpropane est un dérivé halogéné (noté R-Br dans la suite) pouvant réagir avec l'eau. Il s'agit d'une hydrolyse qui aboutit à la formation d'un alcool, le 2-méthylpropan-2-ol (noté R-OH dans la suite). Cette réaction peut être représentée par l'équation suivante :
(CH3)3C-Br(l) + 2H2O  (CH3)3C-OH(aq) + H3O+ + Br-.
(CH3)3C-OH(aq) + H3O+ + Br-.
1.1/ En considérant comme négligable la conductivité de l'eau distilée utilisée, quelle sera la conductivité du mélange réactionnel à l'état initial ?
=> La conductivitée initial dépend de la conductivité du R-Br mais comment trouver la conductivitée du R-Br ? :s
1.2/ La conductivité du mélange réactionnel au cours du temps va-t-elle augmenter ou diminuer ? Justifier.
=> Alors la je sais pas comment trouver la réponse, je dois m'aider de qu'elle donnée ?
1.3/ Faire le tableau d'avancement.
=> Les tableau d'avancement j'arrive generalement à les faire mais la quantité de R-Br je sais pas ou la trouver ect ect :s).
1.4/ Rappeler la relation permettant de calculer la conductivité en  d'une solution à partir des concentrations molaire effectives [Xi] (en mole.m-3) et des conductivités molaires ioniques
d'une solution à partir des concentrations molaire effectives [Xi] (en mole.m-3) et des conductivités molaires ioniques  i (en S.m².mol-1) des differents ions présents en solution.
i (en S.m².mol-1) des differents ions présents en solution.
=> =
=  *c
*c
Merci de votre aide =)
A l'état initial, tu n'as pas d'ions en solution, donc...
La réaction forme des ions! 
Tu n'as pas besoin de connaître la quantité de R-Br, exprime-la par n et donne les quantités de produit en fonction de n et de l'avancement x.
initialement,il n'y a pas d'espèces ioniques en solution ,puisqu'on néglige l'autoprotolyse de l'eau.la conductivité est nulle.
la réaction d'hydrolyse produit des ions H3O+ et Br-,donc la conductivité va croître.
on a initialement no mol de d'halogénoalcane.
en cours de réaction ,on a no-x mol d'halogénoalcane ,x mol d'alcool et x mol de H3O+
la qté no sera donnée au moment du TP,je suppose.
 =
=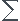
 i*Ci
i*Ci
dans ce cas
 =
= (H3O+)*C +
(H3O+)*C + (Cl-)*C
(Cl-)*C
Merci pour vos aides. Cependant j'ai une question, pourquoi tu introduis Cl- dans ta réponse coriolan ? On parle pas de chlore, si ? ^^'
Désolé du double post,
Si jamais on me demande d'exprimer l'avancement x à un instant t de la réaction il faut que je procède comment ?
J'ai une formule de donné mais je comprend pas comment il a trouver ca ^^': x(t) = ( *V)/(
*V)/( H3O+ +
H3O+ +  Br-)
Br-)
Tiens, on a le même sujet... x)
Tu pars de ça :  (t) = (
(t) = ( H3O+[H3O+](t) + (
H3O+[H3O+](t) + ( Br-[Br-](t)). x(t)/V
Br-[Br-](t)). x(t)/V
Ensuite il y a une question que je ne comprend pas : Vérifier par analyse dimensionnelle que l'avancement x(t) s'exprime bien en moles.
ETUDE EXPERIMENTALE
On a réalisé une solution alcoolique de R-Br en introduisant un volume V(R-Br)= 20,0 mL de 2-bromo-2-méthylpropane dans une fiole jaugée de volume V0= 200,0 mL et en complétant avec de l'éthanol absolu.
2.1 Justifier en 2 lignes le choix de réaliser une solution alcoolique plutot qu'une solution acqueuse de 2-bromo-2-méthylpropane.
Je ne sais pas ... :S
2.2 La densité du R-Br est d= 1,22 et sa masse molaire M= 136,9 g/mol. Calculer la quantité de matière en R-Br introduite pour préparer la solution mère. Comment faire puisqu'on ne connait pas la masse de R-Br ?
2.3 On prélève un volume V1= 5,0 mL de la solution mère pour faire le suivi cinétique. Cet échantillon sera introduit dans un volume d'eau distillé V2= 200,0 mL. Calculer la quantité de matière en R-Br présente à l'état initial dans ce système chimique
Comment faire puisqu'on ne connait pas la concentration C de R-Br ?
2.4 En déduire la valeur de l'avancement maximal xmax
Merci pour votre aide =)
PierreFF => Si tu as la formule donnée dans ton cours, tu peux en principe l'utiliser sans la redémontrer.
Me-Cerise => une analyse dimensionnelle se fait grâce à la formule littérale dans laquelle tu remplaces les "éléments" par leurs dimensions. Ex : analyse dimensionnelle de la vitesse : v=d/t. d est en m, t en s, on a donc v en m.s-1.
Tu dois avoir dans les données quelque chose qui t'indique que le dibromotruc est plus soluble dans l'alcool que dans l'eau...
Pour le 2.2, tu as un volume, une densité et une masse molaire, tu devrais arriver à une quantité avec tout ça! 
Tu déduis ta concentration de ton 2.2 pour le 2.3.
Pour la 2.2 j'ai écrit :
n= p(V/M) avec p la masse volumique, M la masse molaire et V le volume de solution de R-Br.
d (la densité)= p/p(eau) donc p= d*p(eau) = 1220 (unité ?)
donc n= p(V/M)= 1,8*10^-1 mol. c'est ça ?
Pour la 2.3 il fau utiliser la formule C= n/V ou n= C*V mais je ne sais pas quelles valeurs inclure dans ces formules pour calculer la quantité de matière en R-Br présente à l'état initial...
et comment puis-je trouver la valeur de l'avancement maximal ?



