Inscription / Connexion Nouveau Sujet
SSulfate de plomb
bonjour, j'ai besoin de votre aide mais surtout pour verifier mes reponses:
On agite, pendant plusieurs minutes, du sulfate de plomb PbSO4 solide dans de l'eau déminéralisée, dont la température est maintenue à 25°C afin d'obtenir une solution saturée. Le mélange alors obtenu est filtré ; soit C sa concentration en sulfate de plomb.
A l'aide d'une cellule conductimétrique telle que k=S/L=0,91 cm, et d'un montage analogue à celui utilisé en Tp, on mesure:
-la conductance, à 25°C, de la solution obtenue, on trouve Gs=45,4 microsiemens;
-la conductance, à 25°C, de l'eau déminéralisée utilisée pour préparer la solution
saturée, on trouve Ge=5,7 microsiemens.
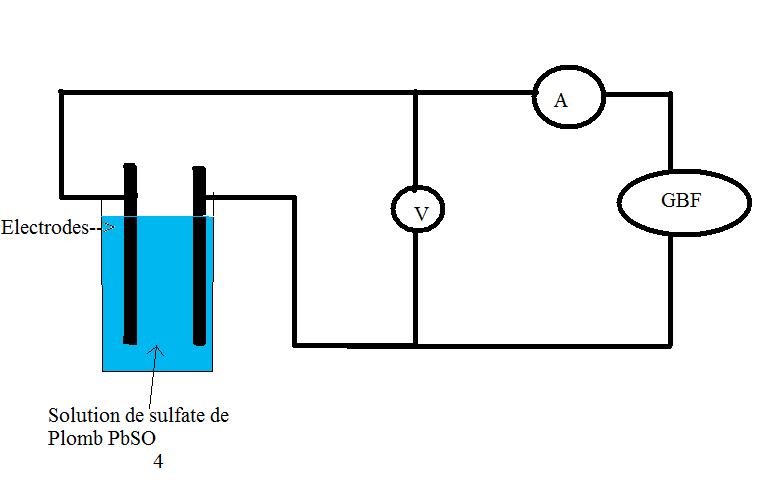
1.Dessiner le montage utilisé pour mesurer les conductances
Euh je fait une cellule conductimétrique ?
2.Ecrire l'équation de la dissolution du sulfate de plomb solide.
PbSO4(s) --> Pb2+ (aq) +SO4 2- (aq)
3.a.Qu'est ce que de l'eau déminéralisée? c'est une eau qui ne contient pas d'ions (ou trop peu).
b.Contient-elle des ions? Oui elle en contient
c.En contient-elle beaucoup? une toute infime partie (dont les ions HO-, H3O+)
4.Que represente G=Gs-Ge?
euh je dirais la conductance = conductance de la solution - conductance de l'eau
grace aux infos on peut donc calculer G par: G= 45.4 - 5.7= 39.7 microsiemens
5.Relier G,k,c,conductivité molaire de Pb2+ et conductivité molaire de SO2-4; en déduire c exprimée en mol.L-1
G= (conductivité molaire de PB2+ et SO42- ) x C x k (k etant egal a S/L)
je fais ma conversion pour que je me complique moins la tete:
G= 39.7 x10^-3 mS et k= 0.91 cm = 9.1x10^-3m
C= G / Conductivité solution x k
C= 39.7 x 10-3 / (14.0 + 16.0) x 9.1x10-3
C= 0.15 mol.m3
C= 0.15x10-3 mol.L-1
6.la solubilité du sulfate de plomb augmente avec la température; qu'observe t-on si on plonge la solution saturée ci-dessus dans un bain eau-glace?
dirais que des cristaux ionique vont se former....
DONNEES à 25°C:
conductivité molaire de Pb2+=14,0 mS.m².mol-1
conductivité molaire de SO2-4=16.0 mS.m².mol-1
je te propose cette correction pour cet exercice :
1) Voir schéma ci-dessous
N'oublies pas que pour tester les conductances, on utilise une sonde conductimétrique qui utilise un courant alternatif. On utilise toujours un courant alternatif pour éviter les réactions d'électrolyse et les phénomènes de polarisation des électrodes 
2)Avant d'écrire l'équation bilan de cette solution, écris le solide ionique en présence, ainsi que les ions qu'il est susceptible de donner. N'oublies pas les notions aq (aqueux) , spécifique lorsque le solvant est de l'eau pure ( eau déminéralisée ) ainsi que s ( solide ) lorsque tu dissous un solide ionique.
Le solide ionique en présence est :
PbSO4. Il est susceptible, une fois solvaté, de former les ions : Pb2+ et SO42-.
L'équation de la réaction est donc :
PbSO4(s) ---->(H2O) Pb2+(aq) + SO42-(aq).
3.a.Une eau déminéralisée est une eau débarrassée de ses ions, donc ne contenant que des molécules H2O. ( on peut tenter d'obtenir une eau déminéralisée par distillation (réalisation plutôt longue ) ou nanofiltration ( souvent utilisé par les laboratoires ) ).
b. Oui, bien souvent elle contient encore des ions. En effet, ici, sa conductance n'est pas nulle ( Ge = 5,7µS donc Ge 0), mais plutôt faible.
0), mais plutôt faible.
c.L'eau déminéralisée a été débarrassée de la plupart de ses ions, mais pas de la totalité, car sa conductance est plutôt faible.
4.L'expression G = Gs-Ge représente la conductance due aux ions Pb2+et SO42- [ essaie d'être plus précis ... les valeurs ici n'ont pas d'importance. ]
5.On sait que la conductance est égale au produit de la constante k de la cellule par la conductivité  , liée elle-même à la concentration.
, liée elle-même à la concentration.
On a : G =  . k et
. k et  =
=  Pb2+.[Pb2+] +
Pb2+.[Pb2+] +  SO[sub]42-[/sub]. [SO42-].
SO[sub]42-[/sub]. [SO42-].
On sait d'après l'équation de dissolution que lorsque on dissous une mol de sulfate de plomb on obtient une mol d'ions Pb2+ et une mol d'ions SO42-
Ainsi, on a : C = [Pb2+] = [ SO42- ].
Donc :  = (
= ( Pb2+ +
Pb2+ +  SO[sub]42-[/sub]).C.
SO[sub]42-[/sub]).C.
On a alors : G = k . ( Pb2+ +
Pb2+ +  SO[sub]42-[/sub]).C.
SO[sub]42-[/sub]).C.
N'oublies pas de faire les conversions d'unités néccéssaires :
La constante de la cellule k doit être donnée en mètres.
k = 0,91cm = 0,91.10-2m = 9,1.10-1 (pense à donner l'écriture scientifique )
On peut aussi calculer G :
G = Gs-Ge = 45,4 - 5,7 = 39,7µS = 39,7.10-3mS = 3,97.10-2mS ( écriture scientifique ).
Ici, on donne la conductance en mS, car la conductivité molaire ionique est donnée en mS.m².mol-1 ( on harmonise donc les unités)
Cela nous donne :
G = k. ( Pb2+ +
Pb2+ +  SO[sub]42-[/sub]).C.
SO[sub]42-[/sub]).C.
<=> C = G / k. ( Pb2+ +
Pb2+ +  SO[sub]42-[/sub]).
SO[sub]42-[/sub]).
<=> C = 3,97.10-2/ [ 9,1.10-1.(14,0+16,0) ] <=> C = 0,14 mol.m3. (pense aux chiffres significatifs. Ici, le chiffre qui en contient le moins est : ''9,1.10-1'', on conserve donc 2 chiffres significatifs ).
Pense que lors du calcul d'une conductivité, la concentration est donnée en mol.m3. En général, on donne les concentrations en mol.L-1. On a alors : C = 0,14 mol.m3=0,14.10-3mol.L-1 = 1,4.10-4mol.L-1.
6. Dans un bain eau-glace, la température de la solution diminue ( température initiale : 25° ). Ainsi, les ions solvatés vont se cristalliser (solubilité qui diminue), il y en aura donc moins, ce qui diminuera la conductivité. De plus, on peut rajouter que c'est une augmentation de la température qui détermine une augmentation de l'agitation moléculaire. La température, en diminuant, va donc réduire l'agitation moléculaire, ce qui diminue les déplacements des ions dans la solution, donc le déplacement du courant électrique dans la solution est diminué, la conductivité aussi de ce fait.
Voilà une correction que j'ai faite rapidement, revois certains points et n'hésite pas à poster tes questions et d'autres exercices que je me ferais un plaisir de te corriger.
je suis là si tu as des questions. A bientôt !
Andyy de 1er S.
PS (2) : je viens de relire ta correction, elle est très bonne !
attention aux calculs à la calculatrice, si jamais tu n'est pas d'accord avec mes résultats, on essaiera de recalculer ensemble  )
)
Merci beaucoup d'avoir répondu avec autant d'explications, je vais tout relire et comparer et si il y a un soucis je te tiens au courant =D
je crois que tu t'es trompé dans ta conversion
k = 0,91cm = 0,91.10-2m = 9,1.10-1 (pense à donner l'écriture scientifique )
c'est pas plutot 9,1.10-3 m ?
t'es sur qu'il faut arrondir à 0.14 ?
Les chiffres significatifs de toute façon je me loupe toujours
Et est-ce que tu pourrais m'aider à résoudre d'autres exercices? pour m'entrainer si ça te derrange pas, car j'en ai poster d'autre mais personne n'a vraiment su m'aider...
je te propose de me donner les liens des exercices, je viendrais t'aider avec grand plaisir !
pour les chiffres significatifs, je suis sur, tu dois mettre le nombre de chiffres significatifs du chiffre qui en contient le moins. Ici, c'est 9,1 ; soit 2 chiffres significatifs. Le résultat devra donc en contenir deux.
C'est plus clair ? ^^
Pense que le nombre de chiffres significatifs c'est tous les chiffres de droite qui ne commencent pas par 0.
par exemple :
0,98745 : 5 chiffres significatifs . 0,125480000 : 9 chiffres significatifs. 0,14520 : 5 chiffres significatifs .
C'est mieux compris ? ^^
en ce qui concerne l'erreur que tu as vu, oui c'est bien une érreur, et c'est bien 10^-3, j'avais posté un message hier concernant cette erreur mais je vois qu'il n'a pas été posté .... en tout cas cela ne change pas le résultat final, c'était juste une erreur dans mon recopiage ^^
Donc envoie moi tes liens, je viendrais te corriger ^^
Si tu veux prendre mon adresse MSN n'hésite pas ^^
C'est sympa de m'aider car je suis pas trop douée en physique/chimie malheureusement..
alors j'avais mis cet exo : ![]() Exercice puissance d'une force
Exercice puissance d'une force
et un autre en chimie : ![]() Exercice conduction dans les solutions
Exercice conduction dans les solutions
J'en ai mis un 3ème mais il y a déja quelqu'un qui m'aide à le résoudre 
Et j'en ai encore d'autres sur mon livre que je n'ai pas trop compris mais déjà si je comprend ces deux là c'est déja trés bien. 


