Inscription / Connexion Nouveau Sujet
Spectrométrie de masse
Bonjour, je cherche à résoudre un exercice sur la spectrométrie de masse qui se compose en deux partie voici l'énoncé :
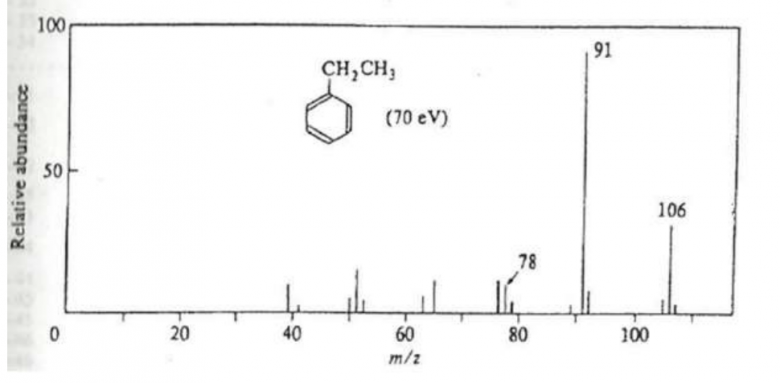
L'analyse de l'éthylbenzene (C6H5CH2CH3) produit le spectre de la figure ci-dessous
Figure 1. Spectre de l'ethylbenzene
a. A quel mode d'ionisation correspond le spectre de la figure 1 ? Justifiez votre réponse
b. Indiquez le pic de base ; comment est-il formé (à la perte de quel groupement
correspond ce fragment) ?
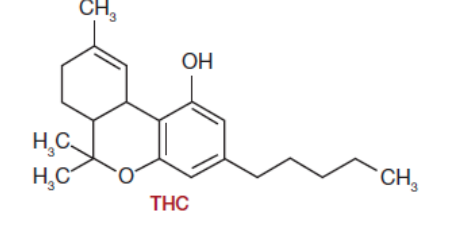
2. Le Δ9-tetrahydrocannabinol (THC) (C21H30O2) est un constituent psychoactif du cannabis.
Il a été analysé par chromatographie liquide couplée à la spectrométrie de masse, selon les
conditions suivantes :
Instrument: Agilent®1200
Détection: AB SCIEX API 3200™ MS/MS, ESI
Colonne: Kinetex C18 (50 x 2.1 mm, 2.6 μm)
Les phases mobiles sont constituées d'ammonium formate et MeOH/ACN contenant de l'acide formique.
Pour quantifier le THC contenu dans des échantillons sanguins, l'étalon interne utilisé est le
THC-D3 (composé isotopique). 2 transitions MRM sont suivies pour chaque composé comme
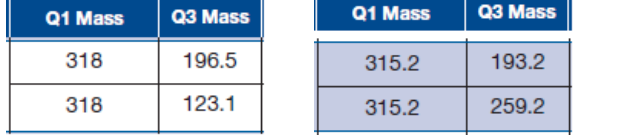
indiqué ci-dessous, le quadrupole Q1 renseignant sur la masse de l'ion parent
a. Quel est le mode d'ionisation utilisé ? Justifiez votre réponse
b. Quel est le type d'ion généré
c. Indiquez les masses m/z de l'ion parent pour le THC et THC-D3, respectivement ;
Justifiez votre réponse.
Voici mes réponses :
1. a) L'indication "(70 eV)" entre parenthèses dans le spectre de l'éthylbenzène suggère que le mode d'ionisation utilisé est l'impact électronique (EI). L'impact électronique est une méthode courante de ionisation en spectrométrie de masse, dans laquelle des électrons à haute énergie sont utilisés pour ioniser les molécules cibles.
L'énergie d'ionisation de 70 eV spécifiée dans le spectre indique la quantité d'énergie appliquée aux électrons pour ioniser les molécules d'éthylbenzène. Dans cette technique, les molécules sont bombardées par des électrons énergétiques, formant des ions moléculaires et des fragments de fragmentation. Ces ions sont ensuite analysés pour produire un spectre de masse.
b) Le pic de base correspond au pic le plus intense présent sur le spectre donc on peut en déduire qu'il s'agit du pic disposant d'une masse moléculaire de 91 car c'est celui qui est le plus intense. Ce fragment correspond à la perte du groupement méthyle (CH3) (car 106-91= 15 qui correspond au CH3, sachant que 106 correspond au poids moléculaire de notre molécule)
2. a) L'instrument utilisé pour la détection est équipé de la source d'ionisation ESI (Electrospray Ionization), ce qui suggère que l'électronébulisation a été utilisée pour ioniser les échantillons.
b) Le type d'ion généré est l'ion [M+H]+, ce qui signifie que les molécules sont ionisées en ajoutant un proton (H+) pour former un ion moléculaire positif. (je ne suis pas certaine de cette réponse)
c) Pour celle ci je n'ai pas su comment m'y prendre
Pourriez-vous m'aider s'il vous plaît ?
Merci d'avance pour votre réponse.