Inscription / Connexion Nouveau Sujet
Solubilité et caractère dipolaire
Bonjour, j'ai un DM à faire sur un de mes exercices du livre mais je ne parviens pas à le résoudre, il est assez long dont je le donnerai par fragment puis je pense pouvoir répondre à certaines questions seule.
Donc on a :
Pour déterminer le caractère dipolaire ou apolaire de certaines molécules, on se propose d'étudier la solubilité dans l'eau des espèces chimiques qu'elles constituent.
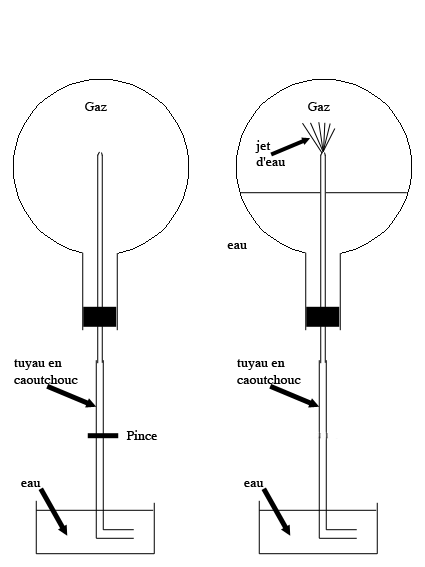
1. On essaie de réaliser l'expérience du jet d'eau avec les gazs suivants : Propane : C3H8, Amoniac NH3,chrorure d'hydrogène HCl, méthane CH4. L'obtention du jet d'eau n'a lieu que pour les gaz NH3 et HCl.
a) La molécule d'eau a un caractère dipolaire. Expliquer pourquoi.
b) Rappeler en quoi consiste l'expérience du jet d'au et déduire les résultats expérimentaux quels sont les gaz solubles dans l'eau.
J'ignore totalement ce qu'est l'expérience du jet d'eau et je me demande ce que signifie dipolaire, es ce que c'est l'équivalent de polaire ?!
J'ai besoin d'aide
Bonsoir,
L'expérience du jet d'eau est schématisée ci-dessous. Elle sert à tester la solubilité des gaz dans l'eau (ou un autre liquide éventuellement).
On a un ballon fermé contenant un gaz à la pression atmosphérique. On introduit de l'eau à l'intérieur. Si le gaz est soluble dans l'eau, la pression va diminuer. Quand on enlève la pince, on voit apparaître un jet d'eau dû à la différence de pression entre l'air atmosphérique et l'intérieur du ballon.
Si le gaz n'est pas soluble dans l'eau, il n'y a pas de jet d'eau.
Une molécule a un caractère dipolaire lorsque le barycentre des charges positives n'est pas au même endroit que le barycentre des charges négatives. Cela peut être dû également à une différence d'électronégativité entre les atomes de la molécule. La molécule se comporte comme un dipole électrique.
Ainsi, la molécule a un un caractère dipolaire pour la première raison et HCl aussi mais pour la deuxième raison.
Ok merci beaucoup.
Après j'ai une question bien plus loin dans l'exercice où il est dit :
La solution d'acide sulfurique conduit le courant. La solution d'éthanol ne le conduit pas. Quelles sont les entités présentes dans chacune des ces solutions ?
On sait grâce à une question précédente que les solutions conduisant le courant sont des solutions électrolytiques. Je sais pas si ça nous aide.
La solution d'acide sulfurique est ionique (==> solution électrolytique). Elle est composée des ions oxonium H3O+ et sulfate SO42-.
La solution d'éthanol n'est pas ionique. Elle est formée de C2H5OH.
D'accord ! En faite si j'ai bien compris l'acide sulfurique est soluble dans l'eau et se "transforme" en ions alors que l'éthanol lui aussi soluble dans l'eau se "transforme" en molécule ! Merci infiniment ! 




