Inscription / Connexion Nouveau Sujet
Reactions prépondérantes
Bonjour,
dans plusieurs exercices/exemples de chimie, il est question d'établir la réaction prépondérante.
Par exemple, j'ai une solution aqueuse contenant de l'acide éthanoïque.
Dans l'exo il est écrit que l'acide éthanoïque est l'acide le plus fort présent qui va réagir avec la base la plus forte présente H20.
Or l'acide le plus fort présent n'est-il pas H3O+ et la base la plus forte OH- ?
Car s'il n'était pas présent, le produit ionique de l'eau serait nul...
Ou est-ce que je me trompe ?
Merci
Patric.
Merci pour le doc; d'ailleurs il y a exactement l'exemple que j'ai pris.
Pour la règle du gamma ils partent directement de l'acide le plus fort H20 alors qu'il y a normalement des ions oxoniums
dans la solution...
bref malgré que le doc soit instructif, il n'y a pas la réponse à ma question...
La réaction d'un acide fort avec de l'eau est une réaction quasi-totale :
il y aura donc des ions oxonium.

Mais ici, tu as l'acide éthanoïque qui est un acide faible ...
Il y a donc peu de dismutations de l'eau en ou
(tu peux le calculer pour t'en assurer)

Je ne sais pas si j'ai été très clair dans mon premier post,
mais ma question était de savoir par exemple en prenant la reaction en solution aqueuse suivante :
CH3COOH + H2O = CH3COO− + H3O+
pourquoi l'acide éthanoique réagit-il avec l'eau et non avec les ions OH- qui constituent la base la plus forte dans l'eau ?
ou plus simplement pourquoi est-ce la réaction prépondérante n'est pas un truc du style :
CH3COOH + OH- = ...
Bonjour,
Pour qu'une réaction puisse être considérée comme prépondérante, il faut deux conditions :
1° : cette réaction doit avoir la plus grande constante thermodynamique, ce qui, dans ce contexte est équivalent à ce qui a déjà été écrit : "réaction de l'acide le plus fort sur la base la plus forte", règle du gamma, même si cette règle est plutôt appliquée aux réactions d'oxydo-réduction.
2° : (cette condition a été oubliée dans les messages précédents) les réactifs ne doivent pas être des espèces initialement ultra-minoritaires.
D'où la méthode souvent conseillée :
1- Classer tout les couples acide/base susceptibles d'intervenir ;
2- Souligner ou entourer les réactifs possibles, c'est à dire les espèces initialement présentes non ultra-minoritaires.
3- écrire la réaction en faisant réagir l'acide le plus fort parmi ceux sélectionnés sur la base la plus forte parmi celles sélectionnées.
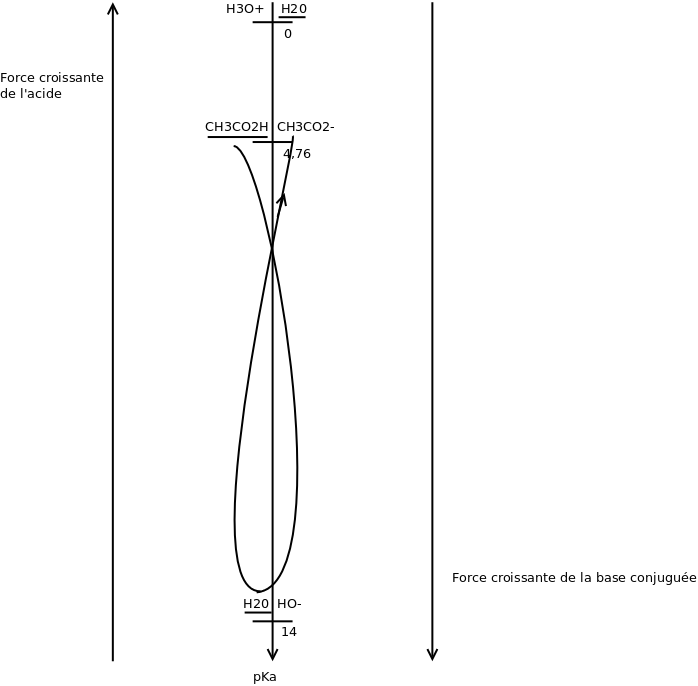
Voici ce que cela donne pour une solution d'acide éthanoïque.
H3O+ ne doit être pris en compte que si un des réactifs est un acide fort, HO- ne doit être pris en compte que si un des réactifs est une base forte, H20 doit toujours être pris en compte.
Bonjour,
merci de la réponse claire, pourrais-tu m'expliquer ta dernière phrase :
> H3O+ ne doit être pris en compte que si un des réactifs est un acide fort, HO- ne doit être pris en compte que si un des réactifs est une base forte, H20 doit toujours être pris en compte.
Patric
H2O est toujours l'espèce ultra-majoritaire : il y a toujours environ 55,6 moles de molécules d'eau par litre de solution aqueuse diluée et l'eau est à la fois l'acide conjugué de HO- et la base conjuguée de H3O+; il faut donc souligner les deux "H2O" du tableau. Dans l'eau, les concentrations en H30+ et en HO- sont de 10-7mol/L à 25° ; ces deux ions sont donc a priori des espèces ultra-minoritaires ; il ne faut donc pas les considérer comme des réactifs possibles d'une réaction prépondérante sauf si l'eau contient un acide fort ou une base forte (acide chlorhydrique, soude...) ; par exemple : si on fait réagir de l'acide chlorhydrique (H30+,Cl-) sur de la soude (Na+,HO-), H30+ et HO- ne sont pas des ions ultra-minoritaires , il faut les souligner dans le tableau et la réaction prédominante devient :
H3O+ + HO- = 2H20
Si tu n'es pas sûr de toi, entraîne toi à trouver les réactions prépondérantes sur divers exemples et propose ici tes réponses ; tu trouveras de l'aide si nécessaire.
Bonjour 
Juste une petite précision pour vanoise : le gamma que tu as tracé n'est-il pas censé être "dans l'autre sens" ? Je m'explique, n'est-il pas censé relier les couples : avec
?
Je pose juste la question pour que Patric ne soit pas embrouillé dans le cas où le gamme est "dans l'autre sens".
Florian
Merci à vanoise et à Florian d'avoir pris le relai en mon absence.
A travers l'exemple, je cherchais à te montrer que tu avais la possibilité de déterminer la concentration en ions oxonium ou hydroxydes, et voir qu'ils étaient ultra-minoritaires par rapport à l'eau ou l'acide acétique.
 .
.
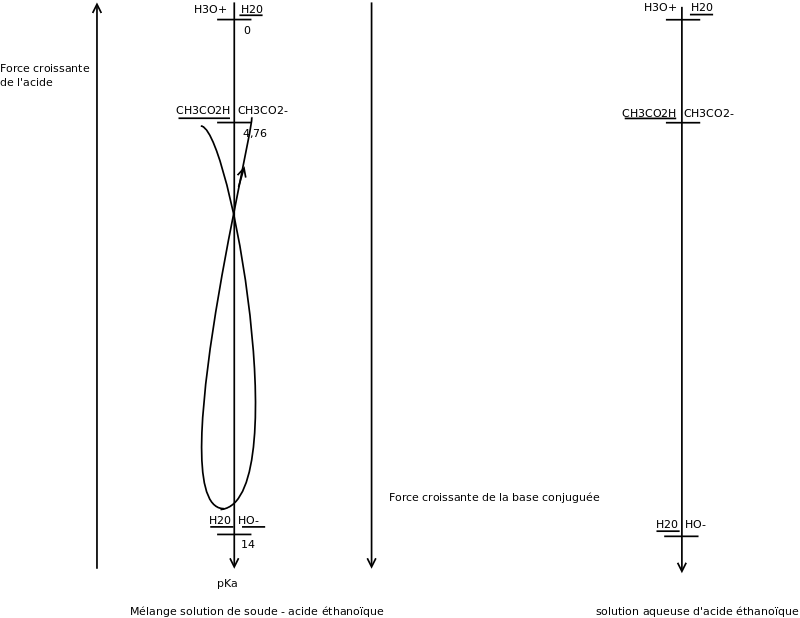
Merci à Florian ! Le diagramme des pKa que j'ai fourni précédemment s'applique à la réaction entre l'acide éthanoïque et la soude et non à la réaction entre l'eau et l'acide éthanoïque. Je présente mes excuses pour cette confusion.
Pour être clair, je reprends les deux cas.
Mélange acide éthanoïque + soude : comme je l'ai déjà expliqué, HO- est maintenant une espèce de concentration non négligeable à l'instant où s'effectue le mélange. La réaction prédominante se fait entre l'acide le plus fort et la base la plus forte qui viennent d'être soulignés, soit ici :
CH3CO2H + HO- = CH3CO2- +H2O
De plus, il se trouve que le sens de cette réaction correspond à la règle du gamma : cela signifie que la constante de cet équilibre est très grande devant 1 ; la réaction est donc quasi totale (quantitative comme on dit aussi).
Mélange eau + acide éthanoïque : maintenant, HO- est avant réaction une espèce ultra-minoritaire et n'est pas souligné. La réaction se fait toujours entre l'acide le plus fort et la base la plus forte. Pas de difficulté : le seul acide souligné est CH3CO2H, la seule base soulignée est H2O ; d'où la réaction :
CH3CO2H + H20 = CH3CO2- + H30+
Le sens de cette réaction ne vérifie pas la règle du gamma ; cela signifie que la constante d'équilibre est très petite devant 1 ; à l'équilibre, le taux d'avancement de la réaction sera très faible : environ 2,9% de l'acide réagit sur l'eau quand on introduit dans l'eau 0,1mole d'acide éthanoïque par litre de solution.
Une petite correction à mon message précédent faite en rouge :
Mélange eau + acide éthanoïque : maintenant, HO- est avant réaction une espèce ultra-minoritaire et n'est pas souligné. La réaction se fait toujours entre l'acide le plus fort et la base la plus forte. Pas de difficulté : l'acide souligné le plus fort est CH3CO2H, la seule base soulignée est H2O ;


