Inscription / Connexion Nouveau Sujet
Réaction lente ou rapide ?
Bonjour , j'ai un exercice de chimie à résoudre , qui me pose pas mal de difficultés . Le voici :
"Les ions peroxodisulfate S2082- réagissent avec les ions iodure . Les produits de la réaction sont des ions sulfate SO42- et du diiode .
A) Ecrire l'équation de cette réaction .
On étudie la cinétique de cette réaction chimique , pour trois conditions expérimentales différentes , représenté dans le tableau si joint ( tableau un ) . L'indice i pour les concentration signifie qu'il s'agit des concentrations initiales dans le mélange . A l'aide d'une échelle de teintes , on détermine la durée de formation du diiode à une concentration donnée . On obtient les résultats suivants : ( tableau 2)
b) Associer à chaque système chimique l'expérience qui lui correspond .
c) Justifier le fait que la technique de mesure utilisée était adaptée à l'étude cinétique de la réaction pour les trois conditions expérimentales choisies .
d) Serait-ce encore vrai , si on voulait suivre l'évolution de la concentration en diiode par des titrages successifs ?
e) Afin de réaliser un titrage à t=7,5min , on a prélevé 10,0ml du systeme A que l'on a versé immédiatement dans 100ml d'eau glacé . Justifier ce mode opératoire .
f) Le titrage par une solution de thiosulfate de sodium de concentration en soluté apporté 0,010 mol.l-1 conduit à un volume à l'équivalence Veq= 8,2 mL . Calculer la concentration en diiode de la solution titrée ."
J'ai quelques idées :
a) L'équation de la réaction est : S2082- + 2I- --> I2 + 2S042-
b) Je ne vois pas tellement le rapport entre les deux tableaux :: puisque dans le premier tableau on a seulement [S2082-] et [I-] alors que dans l'autre [I-] , dois je faire un tableau d'avancement , pour en déduire les concentrations ? Enfin oui , il est vrai que cette question me perd un peux .
c) Je ne vois pas de quelle technique de mesure utilisée , parle-t-il ?
d) Aucune idée
e) Pour justifier le mode opératoire , doit on juste dire que l'on fait ici une trempe pour stopper la réaction ?
Je sais que tout cela est long , est que je n'ai pas beaucoup d'idée , mais au contraire je suis là pour comprendre de moi-même avec l'aide de quelqu'un et non pas pour avoir les réponses tout cru . Donc si quelqu'un pouvait m'aider , je le remercie d'avance .
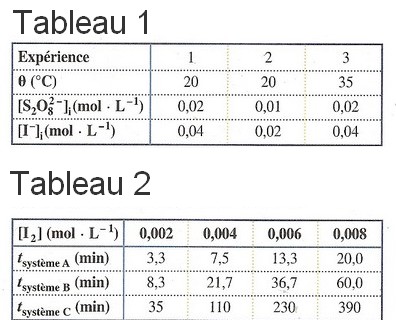
tracer sur le même graphique [I2] =f(t) à partir du tableau D .(on peut limiter la valeur max de l'abscisse à 110 pour éviter de prendre inutilement trop de place.
Cela permet de comparer les vitesses de formation de I2 dans les cas ABC.
dans le tableau 1
quels sont les facteurs qui sont modifiés?
Pour étudier l'influence d'un facteur cinétique,il faut que les autres soient constants .
Quelles colonnes comparer si on veut n'étudier que l'influence d'un facteur
Cela va permettre d'associer aux courbes A,B,C les expériences 1,2,3


