Inscription / Connexion Nouveau Sujet
réaction lente
bonjour,
voila le debut de l'énoncé que j'ai déja fait :
I. REACTION D'OXYDOREDUCTION
La réaction met en jeu les deux couples suivants: MnO4
-
(aq) / Mn2+
(aq) et CO2 (aq) /H2C2O4 (aq) .
2.1. Écrire les deux demi-équations d'oxydoréduction de ces deux couples, puis l'équation de la
réaction entre les ions permanganate et l'acide oxalique.
2.2. On mélange V1 = 20,0 mL de la solution aqueuse de permanganate de potassium de concentration
molaire apportée c1 , acidifiée par de l'acide sulfurique, à V2 = 20,0 mL d'une solution aqueuse
d'acide oxalique de concentration molaire apportée c2 = 5,00 ´ 10 -2 mol.L-1.
Quelle est, à l'instant t = 0, la quantité de matière n01 d'ions permanganate ?
2.3. Quelle est, à l'instant t = 0, la quantité de matière n02 d'acide oxalique ?
2.4. Calculer l'avancement maximal xmax. En déduire le réactif limitant.
2.5. Les ions Mn2+
(aq) ne colorent pas le milieu réactionnel.
Comment va évoluer la couleur du mélange lorsque la transformation se déroule ?
II) Etude cinétique
La transformation chimique supposée totale étant lente, on peut suivre son évolution par
spectrophotométrie. On mesure l'absorbance A du mélange réactionnel placé dans la cuve du
spectrophotomètre.
2-6 . Comment faut-il procéder pour mesurer l'absorbance A de la solution coloré ? (la question m'est pas très compréhensible) !
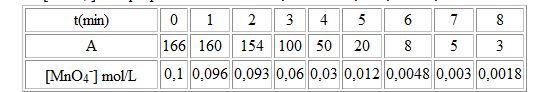
2.7 . Dans les conditions de l'expérience, la concentration des ions permanganates [MnO4-] est proportionnelle à la valeur de l'absorbance A mesurée. Compléter le tableau suivant : (que j'ai deja complété)
javascript:void(0)
attachement 1
2.8. En utilisant le tableau d'avancement, determiner la relation entre [MnO4-] et l'avancement de la réaction.
Mon tableau d'avancement est-il bon ?
javascript:void(0)
attachement 2
2.9. tracer la courbe x=f(t)
3. Définir la vitesse v de la réaction!
3.1. Déterminer la vitesse à la date t=2
3.2. Préciser comment varie, en fonction du temps, la vitesse v.
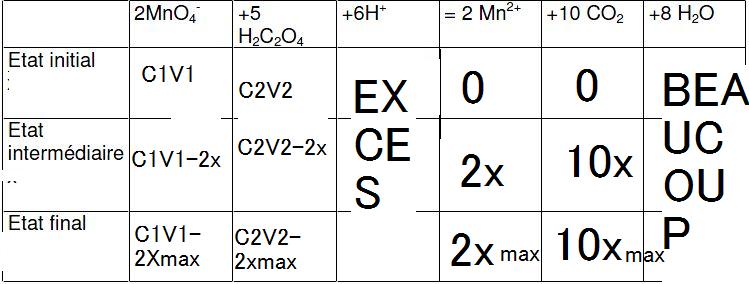
Bonjour,
Je suppose que tu as oublié de mettre c1 parce que pour calculer n01, c'est indispensable...
Il y a deux erreurs dans la colonne H2C2O4
A part ça, qu'as-tu fait ou pas fait ?
Bonjour
2.1 ) les demis-équations d'oxydoréduction sont simples , voici un conseil c'est 2 CO2 pour la seconde demi-équation
2.2) la quantité c1 est donné dans le tableau
2.3) C . V = n
2.4) le tableau est faux , comme le dit Marc35 , c'est 5x
pour déterminer l'avancement maximal , c'est mieux ainsi !!!
2.5 ) une décoloration progressive
2.6) au contraire , elle est compréhensible , il suffit de proposer un mode opératoire .
2.8 ) nt = C1 . V1 - 2x donc....
3) donnes la définition du cours
et pour la suite , aucune difficulté apparente


