Inscription / Connexion Nouveau Sujet
réactif limitant
Bonjour je ne sais pas comment répondre à cette question :
On mélange 300mL de déboucheur liquide et de 200mL d'acide chlorhydrique de concentration ca = 12 mol/L
Quel est le réactif limitant de la réaction qui se produit ?
(sachant que le déboucheur liquide de formule Na+ + HO- et de la solution d'acide chlorhydrique H3O+ + Cl -. Réaction d'équation : H3O+(aq) + HO-(aq)  2H2O (l)
2H2O (l)
Merci 
salut  !
!
Calcule les quantités de matière. fais un tableau d'avancement.
Les deux ont une concentration identique ?
Oui n = 2,4 mol (pour l'acide chlorhydrique)
par contre pour le déboucheur liquide, je n'ai pas la concentration..
Bonsoir,
Dans un tableau d'avancement, t'as toujours des quantités de matières dedans.
D'abord en première ligne, combien t'en as au début de la réaction
en deuxième ligne, combien t'en as en cours de réaction
et en troisième ligne, combien t'en as en fin de réaction
et ce pour chaque molécules présentes.
J'ai trouvé ça sur internet qui pourrait t'aider:

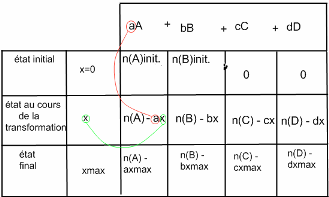
à l'état initial t'as 0 pour C et D car rien n'a été "transformé" encore. C et D ne se sont pas formés puisque c'est le début.
En revanche, le temps passe et trépasse et la réaction évolue! Des quantités de matières de C et D commencent à venir mais A et B peuvent s'épuiser ou continuer à travailler.
Pour savoir si A et B travaillent encore ou non ensemble ou voit ça à la fin. On se rend compte que parfois toutes deux sont épuisées ou que seule une abandonne (dans le cas vu en 1ere) tandis que C et D sont au complet! En fait la plupart du temps on te demande qui est le réactif limitant (celui qui travaille encore (A ou B généralement)) et combien de mol on a de C et/ou de D.
Or une fois que t'as les mol... tu peux trouver de la masse par exemple de C ou de D obtenue!
J'espère que ma simplification en molécules travailleuses t'aidera 
Si pas claire, fais appel!


