Inscription / Connexion Nouveau Sujet
pourquoi les acides carboxyliques ont-ils des °c si élevées
LES QUESTIONS
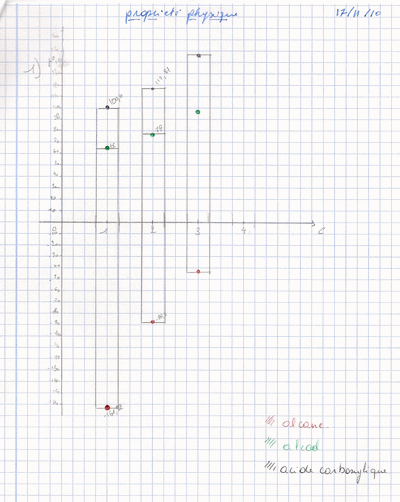
1) Mettre en graphique les temperatures d ébullition de ces composes en fonction du nombre d' atomes de carbone/molécule et en respectant pour chaque groupel' ordre suivant : alcanes,alcools, acides carboxylique.
2) A nombre égal d' atomes de carbone,quelles est la fonction de la molécule qui presente toujours une temperature d ébullition plus élevée que les 2 autres ?
Comment la structure moléculaire peut-elle justifier cette constatation?
(recherche internet !)
3) Les acides carboxyliquesont solubles dans l' eau de C1 a C4, ensuite leur solubilité dans l' eau diminue progressivment. Justifier cette affirmation.
4) Conclusion ?
Mes reponses (incomplet ou pas adapté ???)
j ai fait un grafique mais mon premier n etait pas bon tandis que mon deuxieme graphique en bandelette (ci-dessous) je ne sais pas ci c est ce kelle me demande ...
pour la
2) La temperature d ebullition la plus eleve est celle des acides carboxyliques
"3. Structure et propriétés physiques
La structure électronique du groupe carboxylique est caractérisée par la conjugaison interne du système π, qui a pour conséquence une coplanéité des trois atomes du groupe CO2, tous trois hybrides sp2 (fig. 1). Dans l'ion carboxylate, —CO2-, deux doublets de symétrie p ou π sont partagés entre les trois atomes : ils sont décrits par une première orbitale moléculaire liante, de symétrie π et par une seconde non liante, antisymétrique par rapport au plan contenant les trois noyaux ainsi que par rapport au plan médiateur de la structure. Une troisième orbitale moléculaire, antiliante, inoccupée dans l'état fondamental (lowest unoccupied molecular orbital, L.U.M.O.), est disponible pour recevoir, en partage, un doublet apporté par un réactif nucléophile. Dans l'acide lui-même (—CO2H), les trois types d'atomes se partagent également deux doublets de symétrie p ou π ; la pondération des orbitales atomiques dans les trois orbitales moléculaires est un peu différente de celle de l'anion, mais la structure électronique est décrite d'une manière comparable."
Source: X je ne sais plus la source
sur le net c est ce que j ai trouve mais je ne sais pas si je repond entierement a la question =S
3)"La fonction acide carboxylique est fortement polaire et est à la fois donneur et accepteur de liaisons hydrogène. Ceci permet la création de liaisons hydrogène par exemple avec un solvant polaire comme l'eau, l'alcool, et d'autres acides carboxyliques.
De par cette propriété les acides carboxyliques de petite taille (jusqu'à l'acide butanoïque) sont complètement solubles dans l'eau. Les molécules d'acides sont aussi capables de former des dimères stables par pont hydrogène, ce qui permet d'expliquer pourquoi leur température d'ébullition est plus élevée que celle des alcools correspondants."
Source: Wikipedia
... un coup de pouce je suis totalement perdu =S
même si il est tard , jaccepte encore les suggestions, les corrections, les aides car de toute façon je vais me lever tres tot o matin donc jaurai le temps de jeter un coup d'oeil =)

salut:
ta question n'est pas bien précise .ou est l'énoncé.
il faut bien cibler la question.
la température d'ébullition des hydrocarbures normaux augmente ave le nombre d'atomes de carbones.ceci résulte de l'augmentation des interactions entre les molécules lorsque la chaine augmente.
3) Les acides carboxyliquesont solubles dans l' eau de C1 a C4, ensuite leur solubilité dans l' eau diminue progressivment. Justifier cette affirmation.
La fonction acide carboxylique est fortement polaire et est à la fois donneur et accepteur de liaisons hydrogène. Ceci permet la création de liaisons hydrogène par exemple avec un solvant polaire comme l'eau, l'alcool, et d'autres acides carboxyliques.
De par cette propriété les acides carboxyliques de petite taille (jusqu'à l'acide butanoïque) sont complètement solubles dans l'eau. Les molécules d'acides sont aussi capables de former des dimères stables par pont hydrogène, ce qui permet d'expliquer pourquoi leur température d'ébullition est plus élevée que celle des alcools correspondants.
en plus
Les acides carboxyliques sont liquides dans les conditions normales tant que leur chaine carbonée présente moins de 8 atomes de carbone. Ils sont solides au-delà.



